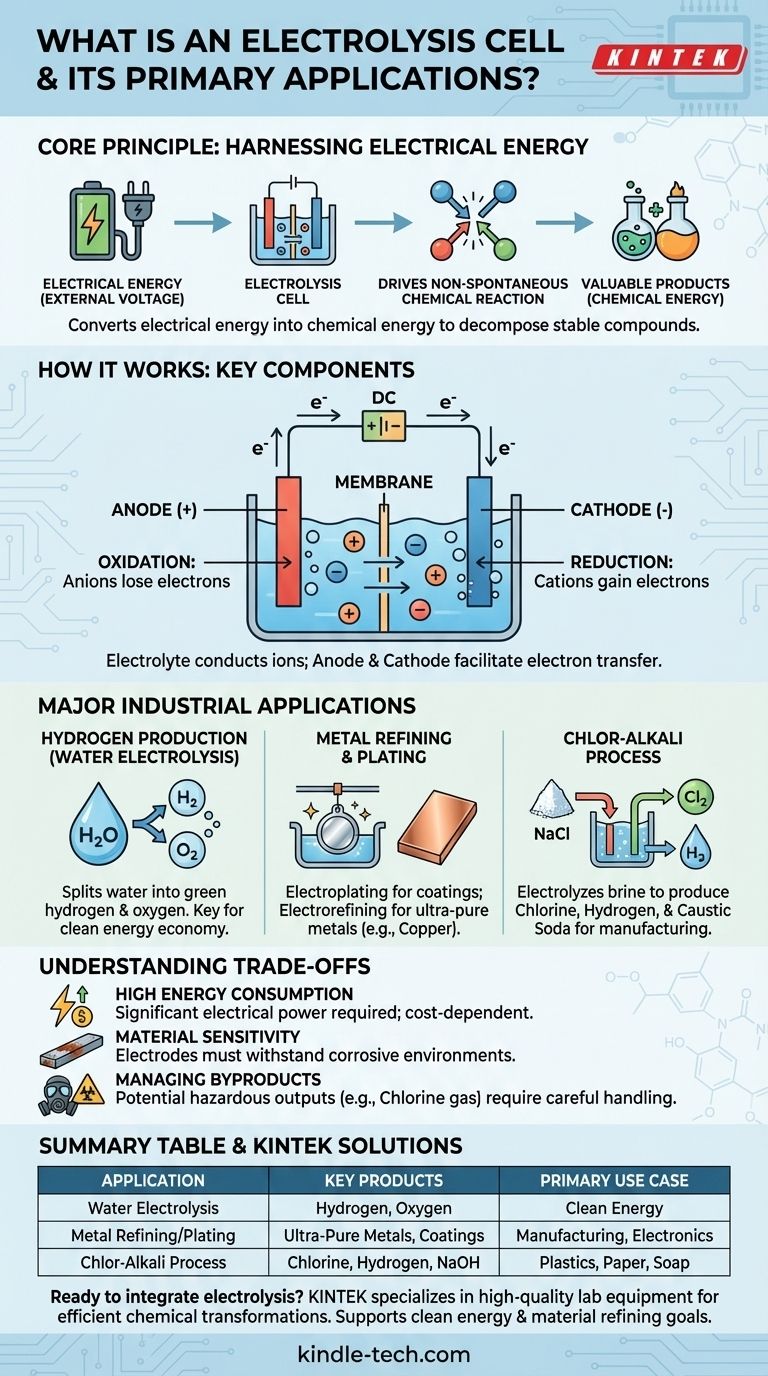
Im Wesentlichen ist eine Elektrolysezelle ein Gerät, das elektrische Energie nutzt, um eine chemische Reaktion anzutreiben, die sonst nicht von selbst ablaufen würde. Sie funktioniert, indem ein elektrischer Strom durch eine Substanz, typischerweise eine Ionen enthaltende Lösung, geleitet wird, um diese zu zersetzen oder umzuwandeln. Zu den wichtigsten industriellen Anwendungen gehören die Produktion von Wasserstoff aus Wasser, die Raffination von Metallen wie Kupfer und die Herstellung wichtiger Chemikalien wie Chlor und Natriumhydroxid.
Eine Elektrolysezelle wandelt im Grunde elektrische Energie in chemische Energie um. Sie überwindet die natürliche Stabilität von Verbindungen und nutzt Elektrizität als Werkzeug, um diese aufzubrechen und neue, oft wertvollere Substanzen zu erzeugen.

Wie eine Elektrolysezelle funktioniert
Eine Elektrolysezelle arbeitet nach dem Prinzip der Elektrolyse, was wörtlich „mittels Elektrizität zerlegen“ bedeutet. Dieser Prozess ist das Gegenteil dessen, was in einer Batterie (einer galvanischen Zelle) geschieht, die Elektrizität aus einer spontanen chemischen Reaktion erzeugt.
Das Kernprinzip: Eine Reaktion erzwingen
Viele wertvolle chemische Verbindungen, wie Wasser (H₂O) oder Salz (NaCl), sind sehr stabil. Sie zerfallen nicht spontan in ihre Bestandteile.
Eine Elektrolysezelle liefert die notwendige Energie in Form einer externen Spannung, um diese nicht-spontanen Reaktionen zu erzwingen. Diese Energiezufuhr überwindet die chemischen Bindungen, die die Verbindung zusammenhalten.
Schlüsselkomponenten
Jede Elektrolysezelle hat drei Hauptkomponenten:
- Anode: Die positive Elektrode. An der Anode verlieren negativ geladene Ionen (Anionen) Elektronen in einem Prozess, der als Oxidation bezeichnet wird.
- Kathode: Die negative Elektrode. An der Kathode nehmen positiv geladene Ionen (Kationen) Elektronen auf in einem Prozess, der als Reduktion bezeichnet wird.
- Elektrolyt: Eine Substanz (oft eine Lösung), die frei bewegliche Ionen enthält. Der Elektrolyt leitet Elektrizität und liefert das Ausgangsmaterial für die Reaktion.
Die Art der Elektroden und der spezifische Elektrolyt werden sorgfältig ausgewählt, da sie direkt bestimmen, welche Produkte gebildet werden.
Wichtige industrielle Anwendungen
Die Fähigkeit, chemische Transformationen mit Elektrizität präzise zu steuern, macht die Elektrolyse zu einem Eckpfeiler der modernen Industrie.
Wasserstoffproduktion aus Wasser
Die wohl meistdiskutierte Anwendung ist heute die Wasserelektrolyse. Durch das Leiten eines Stroms durch Wasser (das einen geeigneten Elektrolyten enthält) spaltet die Zelle H₂O-Moleküle in ihre Bestandteile.
Sauerstoffgas bildet sich an der Anode, während reiner Wasserstoffgas an der Kathode entsteht. Wenn der verwendete Strom aus erneuerbaren Quellen stammt, wird das resultierende Produkt als „grüner Wasserstoff“ bezeichnet, ein Schlüsselbestandteil einer zukünftigen sauberen Energiewirtschaft.
Metallraffination und -beschichtung
Die Elektrolyse ist entscheidend für die Herstellung und Reinigung von Metallen. Beim Galvanisieren wird ein Objekt als Kathode in eine Zelle mit Ionen des gewünschten Beschichtungsmetalls (wie Chrom oder Nickel) gelegt. Die Metallionen werden auf dem Objekt reduziert und bilden eine dünne, haltbare Beschichtung.
Ähnlich wird die Elektro-Raffination zur Herstellung hochreiner Metalle eingesetzt. Eine unreine Kupferplatte wird beispielsweise als Anode verwendet. Wenn Strom angelegt wird, lösen sich die Kupferatome im Elektrolyten auf, wandern zur Kathode und lagern sich als nahezu 100 % reines Kupfer wieder ab, wobei Verunreinigungen zurückbleiben.
Der Chloralkali-Prozess
Dieser massive Industrieprozess ist eine der bedeutendsten Anwendungen der Elektrolyse. Eine starke Natriumchloridlösung (Sole) wird elektrolysiert.
Das Ergebnis ist die Produktion von drei hochgeschätzten Massenchemikalien aus einfachem Salzwasser: Chlorgas, Wasserstoffgas und Natriumhydroxid (Ätznatron). Dies sind grundlegende Bestandteile für die Herstellung von Kunststoffen, Papier, Seifen und Tausenden anderer Produkte.
Die Kompromisse verstehen
Obwohl leistungsfähig, ist die Elektrolyse keine Universallösung. Ihre Anwendung beinhaltet erhebliche Überlegungen.
Hoher Energieverbrauch
Der Hauptnachteil der Elektrolyse ist ihr hoher Energiebedarf. Das Erzwingen des Zerfalls einer stabilen Verbindung erfordert eine beträchtliche Menge an elektrischer Energie, was den Prozess teuer machen kann. Die wirtschaftliche Rentabilität eines elektrolytischen Prozesses ist oft direkt an die Stromkosten gebunden.
Materialempfindlichkeit und Korrosion
Die Elektroden selbst sind Teil einer aktiven chemischen Umgebung. Sie müssen korrosiven Bedingungen und hohen Temperaturen standhalten können, ohne sich zu zersetzen oder unerwünscht zu reagieren. Die Wahl des richtigen Elektrodenmaterials ist entscheidend für Effizienz und Langlebigkeit.
Umgang mit Nebenprodukten
Die Elektrolyse kann gefährliche oder schwer zu handhabende Nebenprodukte erzeugen. Zum Beispiel ist das im Chloralkali-Prozess produzierte Chlorgas giftig und muss mit äußerster Vorsicht gehandhabt werden. Die gesamte Umweltauswirkung hängt stark sowohl von der Stromquelle als auch von der sicheren Handhabung aller Ausgaben ab.
Die richtige Wahl für Ihr Ziel treffen
Das Design und der Betrieb einer Elektrolysezelle sind speziell auf ihren Verwendungszweck zugeschnitten.
- Wenn Ihr Hauptaugenmerk auf der Produktion hochreiner Metalle liegt: Ihr Prozess wird sich auf Elektro-Raffination oder Elektrogewinnung konzentrieren, wo präzise Spannungsregelung und Elektrolytreinheit entscheidend sind, um die Produktqualität sicherzustellen.
- Wenn Ihr Hauptaugenmerk auf der Erzeugung von Massenchemikalien liegt: Sie werden wahrscheinlich ein Modell wie den Chloralkali-Prozess verwenden, das für die kontinuierliche, großtechnische Produktion aus einem kostengünstigen Ausgangsmaterial wie Sole optimiert ist.
- Wenn Ihr Hauptaugenmerk auf der Schaffung sauberer Energieträger liegt: Ihre Bemühungen werden die Wasserelektrolyse umfassen, bei der die Zelleffizienz und die Integration mit kostengünstigen, erneuerbaren Energiequellen die kritischsten Erfolgsfaktoren sind.
Durch die Anwendung gezielter elektrischer Energie wandelt eine Elektrolysezelle grundlegende Inputs in hochwertige Outputs um und macht sie zu einem grundlegenden Werkzeug der modernen Chemie und Industrie.
Zusammenfassungstabelle:
| Anwendung | Schlüsselprodukte | Hauptanwendungsfall |
|---|---|---|
| Wasserelektrolyse | Wasserstoff- & Sauerstoffgas | Saubere Energie (Grüner Wasserstoff) |
| Metallraffination/-beschichtung | Hochreine Metalle, Schutzbeschichtungen | Fertigung, Elektronik |
| Chloralkali-Prozess | Chlor, Wasserstoff, Natriumhydroxid | Kunststoff-, Papier-, Seifenproduktion |
Bereit, die Elektrolysetechnologie in Ihr Labor oder Ihren Industrieprozess zu integrieren? KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien und bietet Ihnen die zuverlässigen Werkzeuge, die Sie für effiziente und präzise chemische Transformationen benötigen. Egal, ob Sie saubere Energielösungen entwickeln oder Materialien raffinieren, unser Fachwissen unterstützt Ihre Ziele. Kontaktieren Sie unser Team noch heute, um zu besprechen, wie wir Ihre Abläufe verbessern können.
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Elektrolysezelle mit fünf Anschlüssen
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Doppelschichtige Fünfloch-Wasserbad-Elektrolysezelle
Andere fragen auch
- Wie sollte die Fünf-Port-Elektrolysezelle mit Wasserbad während eines Experiments betrieben werden? Beherrschen Sie die präzise Steuerung für zuverlässige Ergebnisse
- Wie können Lecks bei der Verwendung einer Fünf-Port-Wasserbad-Elektrolysezelle verhindert werden? Sorgen Sie für einen zuverlässigen und sicheren elektrochemischen Aufbau
- Was sind die Standardkomponenten der Fünf-Port-Wasserbad-Elektrolysezelle? Meistern Sie das Präzisionsinstrument für die elektrochemische Analyse
- Wie kann Kontamination bei Experimenten mit der Fünf-Port-Wasserbad-Elektrolysezelle vermieden werden? Meistern Sie das 3-Säulen-Protokoll
- Wie sind die richtigen Lagerungsverfahren für die multifunktionale Elektrolysezelle? Schützen Sie Ihre Investition und gewährleisten Sie die Datengenauigkeit



















