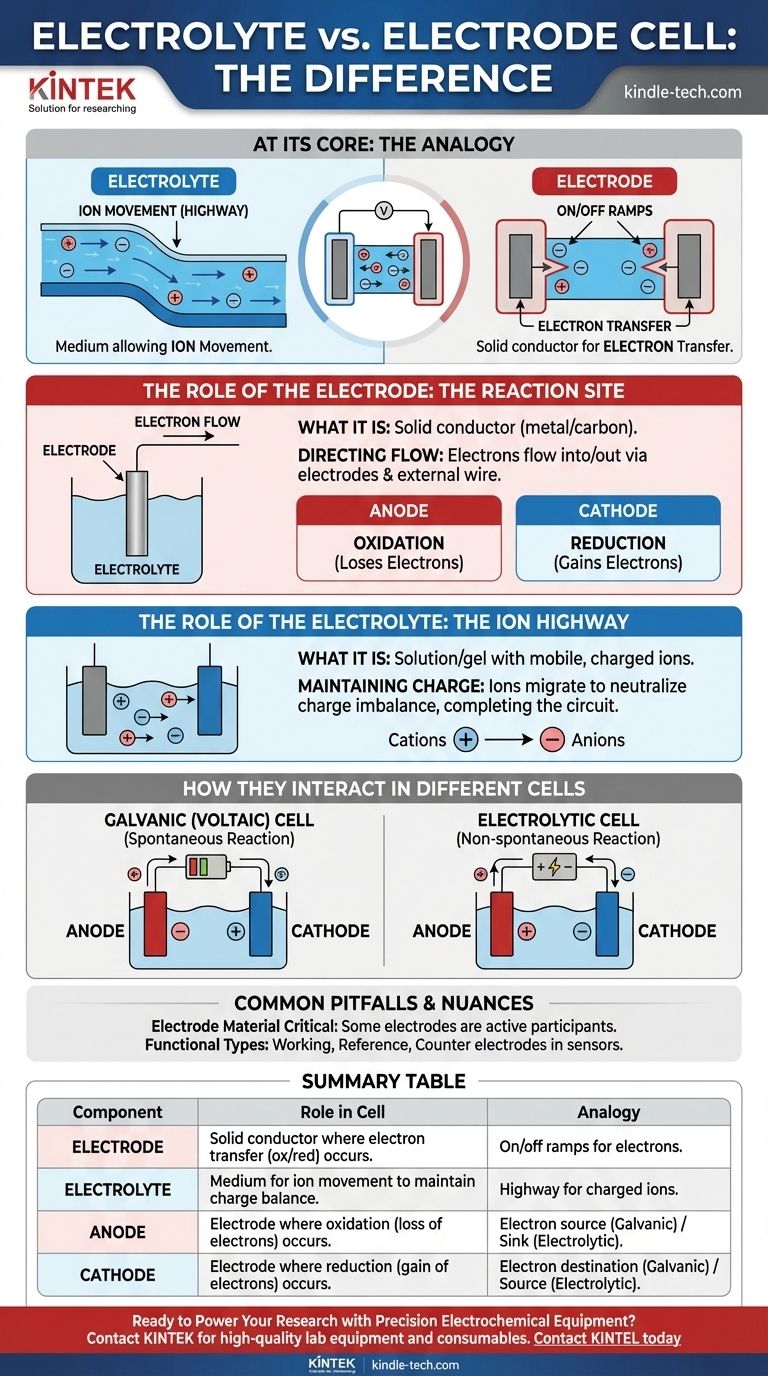
Im Kern ist ein Elektrolyt das Medium, das die Bewegung von Ionen ermöglicht, während eine Elektrode der physikalische Leiter ist, an dem die chemische Reaktion und der Elektronentransfer tatsächlich stattfinden. Der Elektrolyt ist die „Autobahn“ für geladene Ionen innerhalb der Zelle, und die Elektroden sind die „Auf- und Abfahrten“, die diese Autobahn mit dem externen Stromkreis verbinden.
In jeder elektrochemischen Zelle sind Elektroden die festen Leiter, an denen chemische Reaktionen stattfinden, die entweder Elektronen freisetzen oder verbrauchen. Der Elektrolyt ist das notwendige flüssige oder gelartige Medium, das Ionen zwischen diesen Elektroden transportiert und so den Stromkreis schließt.

Die Rolle der Elektrode: Der Reaktionsort
Eine Elektrode fungiert als physikalische Schnittstelle zwischen den chemischen Komponenten in einer Zelle und dem externen elektronischen Schaltkreis.
Was eine Elektrode ist
Eine Elektrode ist ein fester elektrischer Leiter, typischerweise aus Metall oder Kohlenstoff, der in den Elektrolyten eingetaucht wird. Ihre Aufgabe ist es, Elektronen an die Spezies in der Lösung abzugeben oder von ihr aufzunehmen.
Steuerung des Elektronenflusses
Elektronen können nicht durch den Elektrolyten wandern. Stattdessen fließen sie durch die Elektroden und den angeschlossenen externen Draht in die Zelle hinein oder aus ihr heraus.
Anode vs. Kathode
Alle Zellen haben zwei Arten von Elektroden, die durch die Reaktion an ihrer Oberfläche definiert sind:
- An der Anode findet die Oxidation statt (eine Substanz verliert Elektronen).
- An der Kathode findet die Reduktion statt (eine Substanz nimmt Elektronen auf).
Die Rolle des Elektrolyten: Die Ionenautobahn
Der Elektrolyt ist ebenso entscheidend wie die Elektroden. Ohne ihn ist der Stromkreis unvollständig und es kann kein Strom fließen.
Was ein Elektrolyt ist
Ein Elektrolyt ist eine Substanz, typischerweise eine Lösung, die Salze, Säuren oder Basen enthält und beim Auflösen eine elektrisch leitfähige Lösung bildet. Er enthält mobile, geladene Ionen.
Aufrechterhaltung der Ladungsneutralität
Da an der Anode Elektronen freigesetzt und an der Kathode verbraucht werden, würde sich schnell ein Ladungsausgleich aufbauen und die Reaktion stoppen. Der Elektrolyt verhindert dies, indem er seinen Ionen die Wanderung zwischen den Elektroden ermöglicht, wodurch die Ladung neutralisiert und der Prozess fortgesetzt werden kann.
Wie sie in verschiedenen Zellen interagieren
Die spezifische Ladung der Anode und Kathode hängt davon ab, ob die Zelle Elektrizität erzeugt oder verbraucht.
In galvanischen (voltaischen) Zellen
Diese Zellen, wie gängige Batterien, wandeln chemische Energie durch eine spontane Reaktion in elektrische Energie um.
- Die Anode ist negativ, da sie die Quelle der Elektronen für den externen Stromkreis ist.
- Die Kathode ist positiv, da hier die Elektronen in die Zelle zurückkehren.
In Elektrolysezellen
Diese Zellen nutzen externe elektrische Energie, um eine nicht-spontane Reaktion anzutreiben, wie z. B. bei der Galvanik oder Wasserspaltung.
- Die Anode ist positiv, da sie an den positiven Pol der externen Stromquelle angeschlossen ist, um Elektronen wegzuziehen.
- Die Kathode ist negativ, da sie an den negativen Pol angeschlossen ist, um Elektronen aufzuzwingen.
Häufige Fallstricke und Nuancen
Das Verständnis der grundlegenden Definitionen ist der erste Schritt. Die Nuancen zu erkennen, führt zum wahren Verständnis.
Das Elektrodenmaterial ist entscheidend
Die Elektrode ist nicht immer nur ein inerter Leiter. In vielen Batterien ist das Elektrodenmaterial selbst ein aktiver Teilnehmer an der chemischen Reaktion, wie z. B. das Zinkgehäuse einer Alkali-Batterie, das als Anode dient.
Funktionale Elektrodentypen
In der analytischen Chemie und bei Sensoranwendungen erhalten Elektroden spezifischere Namen, die auf ihrer Funktion basieren.
- Eine Arbeitselektrode ist der Ort, an dem die interessierende chemische Reaktion stattfindet.
- Eine Referenzelektrode liefert ein stabiles, konstantes Potenzial zum Vergleich.
- Eine Hilfselektrode schließt den Stromkreis und führt Strom zur Arbeitselektrode.
Die richtige Unterscheidung für Ihr Ziel treffen
Um dieses Wissen anzuwenden, konzentrieren Sie sich auf die grundlegende Rolle, die jede Komponente in Ihrem spezifischen Kontext spielt.
- Wenn Ihr Hauptaugenmerk auf der grundlegenden Batteriewissenschaft liegt: Betrachten Sie die Elektrode als den Ort des Elektronenverlusts/-gewinns (Anode/Kathode) und den Elektrolyten als den wesentlichen Ionenbeweger, der die Batterie am Laufen hält.
- Wenn Ihr Hauptaugenmerk auf der Durchführung der Elektrolyse liegt: Denken Sie daran, dass die Polarität (+/-) der Elektroden im Vergleich zu einer Batterie umgekehrt ist, aber ihre grundlegenden chemischen Rollen (Anode = Oxidation, Kathode = Reduktion) genau gleich bleiben.
- Wenn Ihr Hauptaugenmerk auf dem Aufbau elektrochemischer Sensoren liegt: Sie müssen zwischen der Arbeitselektrode (wo das Ereignis stattfindet), der Referenzelektrode (für eine stabile Messung) und der Hilfselektrode (zum Schließen des Stromkreises) unterscheiden.
Letztendlich sind die Elektrode und der Elektrolyt zwei unterschiedliche, aber untrennbare Komponenten, die die Grundlage aller elektrochemischen Technologien bilden.
Zusammenfassungstabelle:
| Komponente | Rolle in einer elektrochemischen Zelle | Analogie |
|---|---|---|
| Elektrode | Fester Leiter, an dem der Elektronentransfer (Oxidation/Reduktion) stattfindet. | Auf-/Abfahrten für Elektronen zum externen Stromkreis. |
| Elektrolyt | Medium (Flüssigkeit/Gel), das die Ionenbewegung zur Aufrechterhaltung des Ladungsausgleichs ermöglicht. | Autobahn für geladene Ionen innerhalb der Zelle. |
| Anode | Elektrode, an der die Oxidation (Elektronenverlust) stattfindet. | Elektronenquelle (galvanisch) oder Senke (elektrolytisch). |
| Kathode | Elektrode, an der die Reduktion (Elektronenaufnahme) stattfindet. | Elektronenempfänger (galvanisch) oder -quelle (elektrolytisch). |
Bereit, Ihre Forschung mit präzisen elektrochemischen Geräten voranzutreiben?
Das Verständnis der Grundlagen ist der erste Schritt. Die Anwendung mit den richtigen Werkzeugen ist das, was Entdeckungen vorantreibt. Ob Sie neue Batteriematerialien entwickeln, präzise Elektrolyse durchführen oder empfindliche Sensoren bauen – KINTEK liefert die hochwertigen Laborgeräte und Verbrauchsmaterialien, die Sie benötigen.
Wir sind spezialisiert auf die präzisen Bedürfnisse von Laboren. Lassen Sie uns Ihnen helfen, die perfekten elektrochemischen Zellen, Elektroden und Elektrolyte auszuwählen, um genaue und zuverlässige Ergebnisse für Ihre spezifische Anwendung zu gewährleisten.
Kontaktieren Sie KINTEL noch heute, um Ihre Projektanforderungen zu besprechen und herauszufinden, wie unsere Lösungen die Fähigkeiten Ihres Labors verbessern können!
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Elektrochemische Elektrolysezelle mit fünf Anschlüssen
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- Anpassbare Testzellen vom Swagelok-Typ für fortgeschrittene Batterieforschung und elektrochemische Analyse
Andere fragen auch
- Welche wichtigen Vorsichtsmaßnahmen sind bei der Reinigung der Elektrolysezelle zu beachten? Gewährleisten Sie Laborsicherheit und genaue Ergebnisse
- Wie lösen Elektrolysezellen und Gleichstromversorgungssysteme Erkennungsherausforderungen bei der Überwachung der Umweltradioaktivität?
- Warum ist die richtige Auswahl des Elektrolyten für ein Experiment entscheidend? Vermeiden Sie kostspielige Fehler und gewährleisten Sie gültige Ergebnisse
- Was ist der Hauptvorteil von mikro-elektrochemischen Zellen? Maximale Forschung mit minimalen Reagenzien
- Was sind die Temperaturgrenzen einer elektrolytischen Zelle aus Acryl? Vermeiden Sie dauerhafte Schäden, indem Sie unter 80°C bleiben
- Wie beeinflussen ein Gleichstromnetzteil und ein Elektrolysezellensystem die EPD-Ergebnisse? Master Carbon Fiber Modification
- Was sind die wichtigsten Sicherheitsrichtlinien für die Verwendung der Elektrolysezelle? Wesentliche Protokolle für die Laborsicherheit
- Was sind die technischen Vorteile der Verwendung von PEM-Reaktoren für gasförmige Biomasse? Verbesserung von Stabilität und Reinheit



















