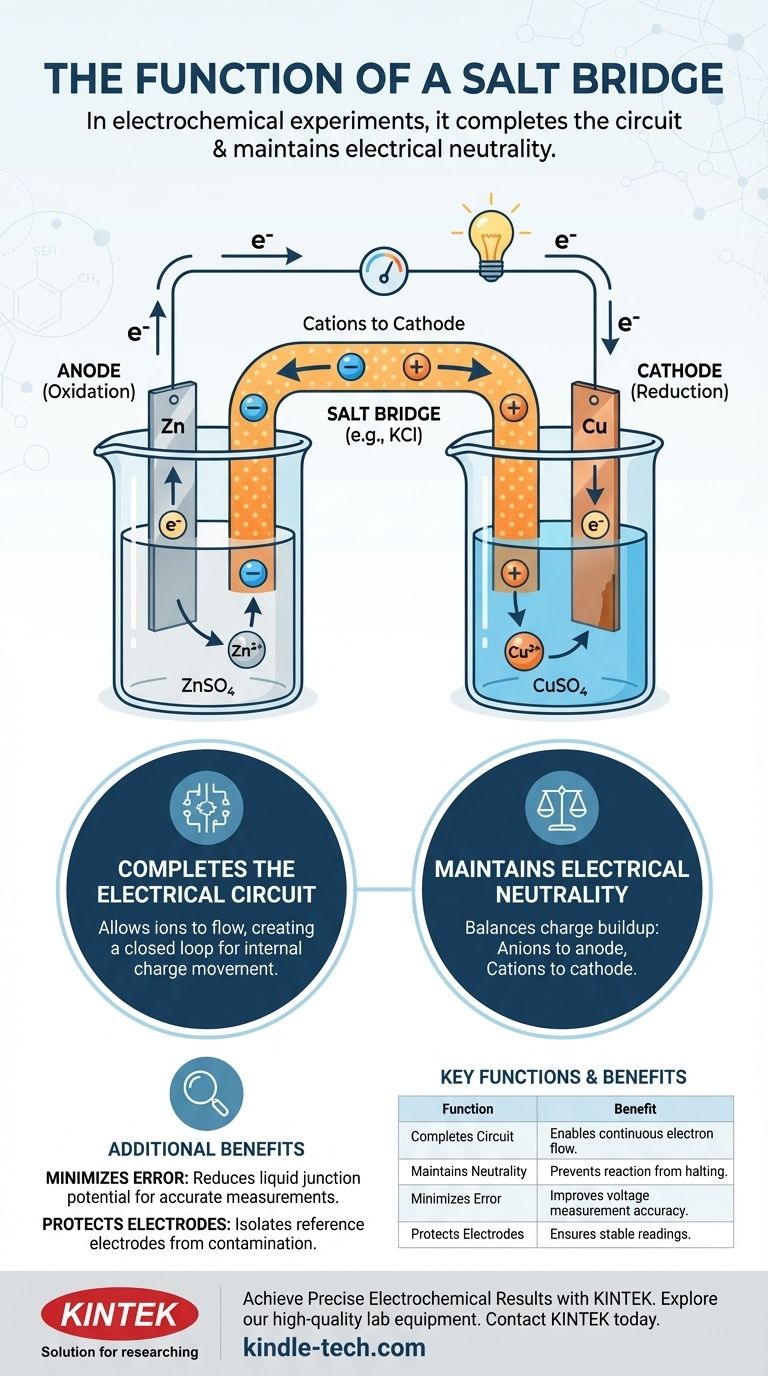
In elektrochemischen Experimenten erfüllt eine Salzbrücke zwei Hauptfunktionen: Sie schließt den elektrischen Stromkreis, indem sie den Ionenfluss zwischen den beiden Halbzellen ermöglicht, und sie erhält die elektrische Neutralität in jeder Halbzelle aufrecht. Ohne diese entscheidende Komponente würde sich schnell Ladung aufbauen, was den Elektronenfluss stoppen und die elektrochemische Reaktion fast sofort unterbrechen würde.
Eine Salzbrücke ist nicht nur ein Verbinder; sie ist der ladungsausgleichende Mechanismus, der eine anhaltende elektrochemische Reaktion ermöglicht. Sie wirkt intern, indem sie Ionen bewegt, um das Ladungsungleichgewicht auszugleichen, das durch extern bewegte Elektronen entsteht.

Die Anatomie einer elektrochemischen Zelle
Um die Funktion einer Salzbrücke zu verstehen, müssen Sie sich zunächst das System vorstellen, in dem sie arbeitet. Eine elektrochemische Zelle ist im Grunde ein Gerät, das chemische Energie in elektrische Energie umwandelt oder umgekehrt.
Die zwei Halbzellen
Eine elektrochemische Zelle besteht aus zwei Halbzellen. Jede Halbzelle enthält typischerweise eine Elektrode (einen festen Leiter wie Zink oder Kupfer), die in eine Elektrolytlösung (eine Lösung, die Ionen enthält, wie Zinksulfat oder Kupfersulfat) eingetaucht ist.
In einer Halbzelle findet Oxidation statt (Elektronenverlust), und diese Elektrode wird als Anode bezeichnet. In der anderen findet Reduktion statt (Elektronenaufnahme), und diese Elektrode ist die Kathode.
Das Problem: Sofortiger Ladungsaufbau
An der Anode erzeugte Elektronen wandern durch einen externen Draht zur Kathode und erzeugen einen elektrischen Strom. Dieser Elektronenfluss erzeugt jedoch ein sofortiges Problem.
Wenn die Anode Elektronen verliert, sammelt sich in ihrer Elektrolytlösung ein Überschuss an positiven Ionen an. Umgekehrt, wenn die Kathode Elektronen aufnimmt, entwickelt ihre Elektrolytlösung einen Überschuss an negativen Ionen (da positive Ionen aus der Lösung verbraucht werden). Diese Ladungstrennung erzeugt eine starke Gegenspannung, die den Elektronenfluss vollständig zum Erliegen bringt.
Die Kernfunktionen einer Salzbrücke
Die Salzbrücke ist die elegante Lösung für dieses Problem des Ladungsaufbaus. Sie ist typischerweise ein U-förmiges Rohr, das mit einer konzentrierten Lösung eines inerten Elektrolyten, wie Kaliumchlorid (KCl) oder Kaliumnitrat (KNO₃), gefüllt ist.
Schließen des elektrischen Stromkreises
Ein vollständiger elektrischer Stromkreis erfordert eine geschlossene Schleife. Der externe Draht ermöglicht den Elektronenfluss, aber das ist nur die Hälfte des Stromkreises. Die Salzbrücke schließt die Schleife, indem sie den Ionenfluss zwischen den Halbzellen ermöglicht und so einen Weg für die interne Ladungsbewegung schafft.
Aufrechterhaltung der elektrischen Neutralität
Dies ist die wichtigste Funktion der Salzbrücke. Um die sich ansammelnde Ladung zu neutralisieren:
- Anionen (negative Ionen) aus der Salzbrücke wandern in die Anoden-Halbzelle, um die entstehenden überschüssigen positiven Ionen auszugleichen.
- Kationen (positive Ionen) aus der Salzbrücke wandern in die Kathoden-Halbzelle, um die überschüssige negative Ladung auszugleichen.
Durch den ständigen Ladungsausgleich in beiden Halbzellen stellt die Salzbrücke sicher, dass die elektrochemische Reaktion ablaufen und ein gleichmäßiger Strom aufrechterhalten werden kann.
Minimierung des Flüssigkeitsjunctionpotentials
Bei präziseren Messungen dient die Salzbrücke auch dazu, das Flüssigkeitsjunctionpotential zu reduzieren. Dies ist eine kleine, unerwünschte Spannung, die an der Grenzfläche zweier unterschiedlicher Elektrolytlösungen entsteht. Durch die Schaffung einer allmählicheren Ionenbrücke minimiert sie diese Fehlerquelle und führt zu genaueren Potentialmessungen der Zelle.
Praktische Überlegungen verstehen
Die Wirksamkeit einer Salzbrücke hängt vollständig von ihrer Zusammensetzung und ihrer Wechselwirkung mit dem Rest der Zelle ab.
Der Elektrolyt muss inert sein
Die Ionen innerhalb der Salzbrücke dürfen nicht mit den Ionen in einer der Halbzellenlösungen reagieren. Die Verwendung einer KCl-Salzbrücke in einer Zelle, die Silbernitrat (AgNO₃) enthält, wäre beispielsweise ein Fehler. Die Chloridionen (Cl⁻) würden mit den Silberionen (Ag⁺) reagieren und einen festen Niederschlag (AgCl) bilden, der die Funktion der Zelle stört.
Schutz der Referenzelektrode
In einem in der Elektrochemie üblichen Drei-Elektroden-Aufbau wird häufig eine Salzbrücke verwendet, um eine Referenzelektrode (die ein konstantes, bekanntes Potential hat) mit der Hauptlösung zu verbinden. Dies geschieht, um die Referenzelektrode zu isolieren und zu verhindern, dass Ionen aus der Testlösung sie kontaminieren und ihr stabiles Potential verändern. Dies verlängert die Lebensdauer der Elektrode und gewährleistet die Messgenauigkeit.
Die richtige Wahl für Ihr Experiment treffen
Die Hauptaufgabe der Salzbrücke besteht immer darin, den Ionenfluss zu erleichtern, aber ihre Bedeutung kann je nach Ihrem Ziel aus verschiedenen Blickwinkeln betrachtet werden.
- Wenn Ihr Hauptaugenmerk auf einer einfachen Demonstration einer galvanischen Zelle liegt: Betrachten Sie die Salzbrücke als die Komponente, die den Stromkreis schließt und den kontinuierlichen Betrieb der Batterie ermöglicht.
- Wenn Ihr Hauptaugenmerk auf präzisen Spannungsmessungen liegt: Die Salzbrücke ist entscheidend für die Minimierung des Flüssigkeitsjunctionpotentials, das eine wichtige Quelle experimenteller Fehler ist.
- Wenn Ihr Hauptaugenmerk auf der analytischen Elektrochemie liegt (z. B. Korrosionsstudien): Die Salzbrücke ist unerlässlich, um Ihre Referenzelektrode zu isolieren und eine stabile, zuverlässige Basislinie für Ihre Potentialmessungen zu gewährleisten.
Letztendlich ermöglicht die Salzbrücke die kontrollierte und kontinuierliche Untersuchung elektrochemischer Reaktionen, indem sie das grundlegende Problem der Ladungstrennung löst.
Zusammenfassungstabelle:
| Funktion | Beschreibung | Hauptnutzen |
|---|---|---|
| Schließt den Stromkreis | Ermöglicht den Ionenfluss zwischen Halbzellen. | Ermöglicht kontinuierlichen Elektronenfluss. |
| Erhält die Neutralität | Gleicht den Ladungsaufbau durch Elektronenübertragung aus. | Verhindert das Anhalten der Reaktion. |
| Minimiert Fehler | Reduziert das Flüssigkeitsjunctionpotential. | Verbessert die Genauigkeit der Spannungsmessung. |
| Schützt Elektroden | Isoliert Referenzelektroden vor Kontamination. | Gewährleistet stabile, zuverlässige Messwerte. |
Bereit, präzise und zuverlässige Ergebnisse in Ihren elektrochemischen Experimenten zu erzielen? Die richtige Ausrüstung ist grundlegend für Ihren Erfolg. KINTEK ist spezialisiert auf hochwertige Laborausrüstung und Verbrauchsmaterialien, einschließlich elektrochemischer Zellen und Zubehör, die auf Genauigkeit und Langlebigkeit ausgelegt sind. Lassen Sie sich von unseren Experten bei der Auswahl der perfekten Ausstattung für Ihre Forschungsbedürfnisse unterstützen.
Kontaktieren Sie KINTEK noch heute, um zu besprechen, wie wir die elektrochemischen Fähigkeiten Ihres Labors unterstützen können!
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Elektrochemische Elektrolysezelle mit fünf Anschlüssen
- Doppelschichtige Fünfloch-Wasserbad-Elektrolysezelle
- PTFE Elektrolysezelle Elektrochemische Zelle Korrosionsbeständig Abgedichtet und Nicht Abgedichtet
Andere fragen auch
- Für welche Art von Elektrodenanordnung ist die elektrochemische Zelle zur Beschichtungsbewertung konzipiert? Schalten Sie präzise Beschichtungsanalysen frei
- Was sind die Vorteile einer flachen elektrochemischen Zelle für die Korrosion? Präzise Lochfraß- und Spaltanalyse erreichen
- Wie wird eine Dreielektroden-elektrochemische Zelle zur Bewertung der Korrosionsbeständigkeit von Zr-Nb-Legierungen eingesetzt?
- Wie funktioniert eine Dreielektroden-Elektrolysezelle? Präzisionsprüfung von 8620er Stahl in korrosiven Umgebungen
- Welchen Volumenbereich hat die Elektrolysezelle zur Beschichtungsbewertung? Ein Leitfaden zur Auswahl der richtigen Größe


















