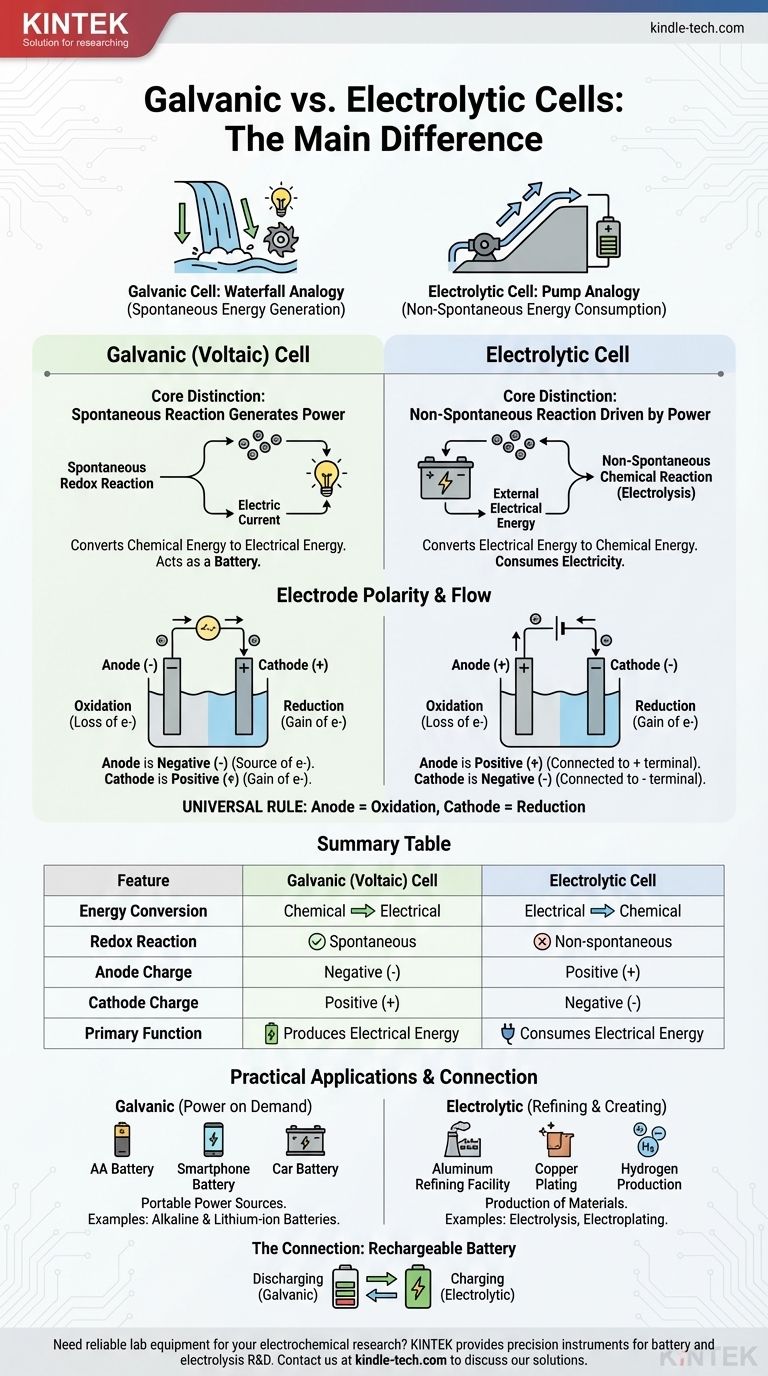
Der grundlegende Unterschied liegt in der Richtung der Energieumwandlung und der Art der chemischen Reaktion. Eine galvanische Zelle wandelt gespeicherte chemische Energie spontan in elektrische Energie um und fungiert effektiv als Batterie. Im Gegensatz dazu verwendet eine elektrolytische Zelle eine externe Quelle elektrischer Energie, um eine nicht-spontane chemische Reaktion zu erzwingen.
Stellen Sie es sich wie den Unterschied zwischen einem Wasserfall, der Energie erzeugt, und einer Pumpe, die Energie verbraucht, vor. Eine galvanische Zelle ist wie ein Wasserfall, bei dem ein natürlicher, spontaner Prozess (Wasser fließt bergab) Energie erzeugt. Eine elektrolytische Zelle ist wie eine Pumpe, die externe Energie nutzt, um einen Prozess zu erzwingen, der von selbst nicht ablaufen würde (Wasser bergauf drücken).

Der Kernunterschied: Spontaneität und Energiefluss
Das Verhalten dieser beiden Zellen wird durch ein Prinzip bestimmt: ob die interne Redoxreaktion von selbst abläuft.
Galvanische Zellen: Spontane Reaktionen, die Strom erzeugen
In einer galvanischen Zelle, auch als voltaische Zelle bekannt, haben die ausgewählten chemischen Reaktanten eine natürliche Tendenz, miteinander zu reagieren.
Diese spontane Redoxreaktion setzt Energie frei. Die Zelle ist so aufgebaut, dass sie diese Energie nicht als Wärme, sondern als gerichteten Elektronenfluss – einen elektrischen Strom – kanalisiert.
Im Wesentlichen nutzt eine galvanische Zelle einen natürlich ablaufenden chemischen Prozess, um elektrische Arbeit zu verrichten. Dies ist das Prinzip hinter allen Batterien.
Elektrolytische Zellen: Nicht-spontane Reaktionen, die durch Strom angetrieben werden
In einer elektrolytischen Zelle ist die chemische Reaktion nicht-spontan. Die Reaktanten würden nicht von selbst interagieren, um die gewünschten Produkte zu erzeugen.
Um die Reaktion ablaufen zu lassen, wird eine externe Stromquelle (wie eine Batterie oder ein Netzteil) an die Zelle angeschlossen. Diese externe Spannung liefert die Energie, die benötigt wird, um die Elektronen zur Bewegung zu zwingen und die chemische Veränderung anzutreiben.
Elektrolytische Zellen verbrauchen Elektrizität, um ein chemisches Produkt zu erzeugen, ein Prozess, der als Elektrolyse bekannt ist.
Ein genauerer Blick auf die Elektrodenpolarität
Obwohl die Begriffe „Anode“ und „Kathode“ konstant sind, ist ihre Ladung (Polarität) ein häufiger Verwechslungspunkt, da sie sich zwischen den beiden Zelltypen umkehrt. Der Schlüssel liegt darin, sich daran zu erinnern, was den Elektronenfluss antreibt.
Die Anode: Immer der Ort der Oxidation
In beiden Zelltypen wird die Anode als die Elektrode definiert, an der die Oxidation (der Elektronenverlust) stattfindet. Diese Definition ist universell.
Die Kathode: Immer der Ort der Reduktion
Ebenso ist die Kathode immer die Elektrode, an der die Reduktion (der Elektronenempfang) stattfindet. Dies ist die zweite universelle Regel.
Der kritische Umschlag: Warum sich die Polarität ändert
Der Unterschied in der Polarität ergibt sich daraus, ob die Reaktion spontan oder erzwungen ist.
In einer galvanischen Zelle setzt die spontane Oxidation an der Anode Elektronen frei, wodurch eine negative Ladung entsteht. Die Anode ist der negative Pol, da sie die Quelle der Elektronen ist, die in den Stromkreis gedrückt werden.
In einer elektrolytischen Zelle wird eine externe Stromquelle verwendet. Ihr positiver Pol zieht Elektronen von der Anode weg, um die Oxidation zu erzwingen. Daher ist die Anode an die positive Seite angeschlossen und wird zum positiven Pol.
| Merkmal | Galvanische (Voltaische) Zelle | Elektrolytische Zelle |
|---|---|---|
| Energieumwandlung | Chemisch zu Elektrisch | Elektrisch zu Chemisch |
| Redoxreaktion | Spontan | Nicht-spontan |
| Anodenladung | Negativ (-) | Positiv (+) |
| Kathodenladung | Positiv (+) | Negativ (-) |
| Hauptfunktion | Erzeugt elektrische Energie | Verbraucht elektrische Energie |
Verständnis der praktischen Anwendungen
Dieser grundlegende Unterschied führt zu unterschiedlichen Einsatzmöglichkeiten in Technologie und Industrie.
Galvanische Zellen in Aktion: Strom bei Bedarf
Galvanische Zellen sind als tragbare Quellen für elektrische Energie konzipiert. Gängige Beispiele sind alle Arten von Batterien, von herkömmlichen AA-Alkalibatterien bis hin zur Lithium-Ionen-Batterie in Ihrem Telefon.
Elektrolytische Zellen bei der Arbeit: Raffinieren und Erzeugen
Elektrolytische Zellen nutzen Strom, um Materialien herzustellen. Wichtige industrielle Prozesse basieren auf der Elektrolyse, wie die Gewinnung von reinem Aluminium aus seinem Erz, die Raffination von Kupfer und die Spaltung von Wasser zur Erzeugung von Wasserstoff- und Sauerstoffgas. Die Galvanik, bei der ein dünner Metallüberzug wie Silber oder Chrom auf ein anderes Objekt aufgebracht wird, ist eine weitere häufige Anwendung.
Die Verbindung: Wie eine wiederaufladbare Batterie funktioniert
Eine wiederaufladbare Batterie ist die perfekte Veranschaulichung beider Zelltypen in einem Gerät.
Wenn sie Ihr Gerät mit Strom versorgt (Entladung), arbeitet sie als galvanische Zelle. Eine spontane chemische Reaktion im Inneren der Batterie erzeugt einen elektrischen Strom.
Wenn Sie sie zum Aufladen anschließen, fungiert das Ladegerät als externe Stromquelle. Es legt eine Spannung an, die die nicht-spontane, umgekehrte Reaktion erzwingt, um die Reaktanten aufzufüllen. Während des Ladevorgangs fungiert die Batterie als elektrolytische Zelle.
Die richtige Wahl für Ihr Ziel treffen
Ihr Ziel bestimmt, welches elektrochemische Rahmenwerk Sie verwenden.
- Wenn Ihr Hauptaugenmerk darauf liegt, Elektrizität aus einem chemischen Prozess zu erzeugen: Sie beschreiben eine galvanische (voltaische) Zelle.
- Wenn Ihr Hauptaugenmerk darauf liegt, Elektrizität zu nutzen, um eine spezifische chemische Veränderung anzutreiben: Sie arbeiten mit einer elektrolytischen Zelle.
- Wenn Sie eine wiederaufladbare Batterie analysieren: Denken Sie daran, dass sie sich während der Entladung wie eine galvanische Zelle und während des Ladevorgangs wie eine elektrolytische Zelle verhält.
Letztendlich sind die Spontaneität der Reaktion und die daraus resultierende Richtung des Energieflusses die bestimmenden Merkmale, die diese beiden Säulen der Elektrochemie voneinander trennen.
Zusammenfassungstabelle:
| Merkmal | Galvanische (Voltaische) Zelle | Elektrolytische Zelle |
|---|---|---|
| Energieumwandlung | Chemisch zu Elektrisch | Elektrisch zu Chemisch |
| Redoxreaktion | Spontan | Nicht-spontan |
| Anodenladung | Negativ (-) | Positiv (+) |
| Kathodenladung | Positiv (+) | Negativ (-) |
| Hauptfunktion | Erzeugt elektrische Energie | Verbraucht elektrische Energie |
Benötigen Sie zuverlässige Laborgeräte für Ihre elektrochemische Forschung? Ob Sie neue Batterietechnologien entwickeln oder Elektrolyseprozesse optimieren – KINTEK liefert die Präzisionsinstrumente und Verbrauchsmaterialien, die Ihr Labor benötigt. Kontaktieren Sie uns noch heute, um zu besprechen, wie unsere Lösungen Ihre Innovationen vorantreiben können!
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Elektrochemische Elektrolysezelle mit fünf Anschlüssen
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Elektrochemische Elektrolysezelle mit Gasdiffusion und Flüssigkeitsströmungsreaktionszelle
- Multifunktionale Elektrolysezellen-Wasserbäder, einlagig, doppelwandig
Andere fragen auch
- Wie wird eine hochpräzise Elektrolysezelle zur Bewertung der Korrosionsbeständigkeit von Metallen eingesetzt? Validieren Sie DCT-Ergebnisse genau
- Was ist der Unterschied zwischen einer elektrolytischen Korrosionszelle und einer elektrochemischen Korrosionszelle? Verstehen Sie die treibende Kraft hinter Korrosion
- Wie wird eine Dreielektroden-elektrochemische Zelle zur Bewertung der Korrosionsbeständigkeit von Zr-Nb-Legierungen eingesetzt?
- Für welche Art von Elektrodenanordnung ist die elektrochemische Zelle zur Beschichtungsbewertung konzipiert? Schalten Sie präzise Beschichtungsanalysen frei
- Welchen Volumenbereich hat die Elektrolysezelle zur Beschichtungsbewertung? Ein Leitfaden zur Auswahl der richtigen Größe















