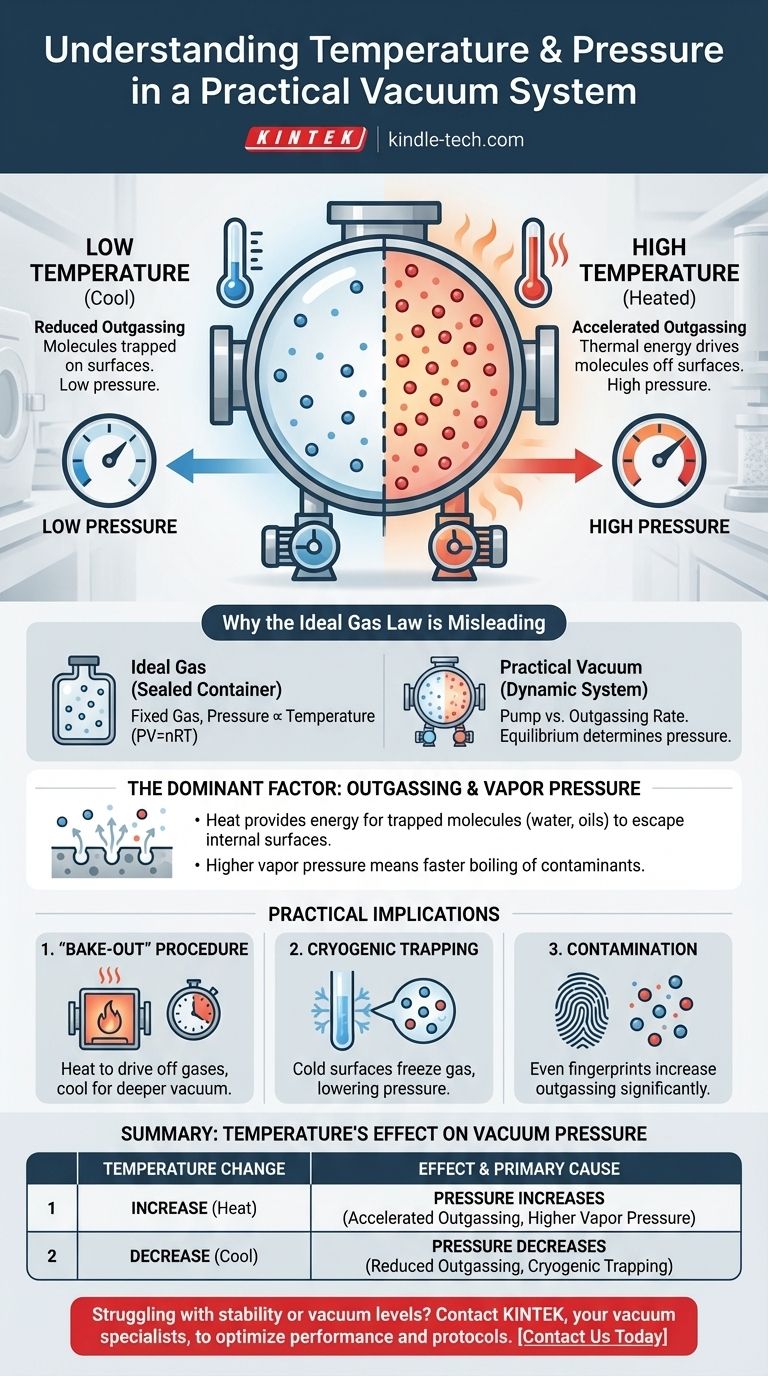
In einem praktischen Vakuumsystem ist die Beziehung direkt: Eine Erhöhung der Systemtemperatur führt zu einem Anstieg des Drucks und verschlechtert somit die Qualität des Vakuums. Dies geschieht, weil Wärme die Energie liefert, damit Moleküle, die auf den inneren Oberflächen der Kammer eingeschlossen sind, in den Vakuumraum entweichen können. Dieser Prozess, bekannt als Ausgasung, ist die dominierende Druckquelle in Hochvakuumumgebungen.
Der Druck in einer realen Vakuumkammer wird nicht durch das ideale Gasgesetz bestimmt, sondern durch die Rate der Ausgasung von ihren inneren Oberflächen. Höhere Temperaturen erhöhen diese Rate, wodurch mehr Gasmoleküle freigesetzt werden und somit der Gesamtdruck steigt.

Warum das ideale Gasgesetz hier irreführend ist
Das Missverständnis eines „eingeschlossenen Gases“
Das bekannte ideale Gasgesetz (PV=nRT) beschreibt die Beziehung zwischen Druck, Volumen und Temperatur für eine feste Gasmenge in einem versiegelten Behälter. In diesem Szenario ist der Druck direkt proportional zur Temperatur.
Eine Vakuumkammer ist jedoch kein versiegelter Behälter mit einer festen Gasmenge. Es ist ein dynamisches System, in dem eine Pumpe aktiv Moleküle entfernt.
Die Realität: Ein dynamisches Gleichgewicht
Der Druck in einem Vakuum wird durch das Gleichgewicht zwischen der Rate, mit der die Pumpe Moleküle entfernt, und der Rate, mit der neue Moleküle in das System gelangen, bestimmt. Die primäre Quelle dieser neuen Moleküle sind die inneren Oberflächen der Kammer selbst.
Der dominierende Faktor: Ausgasung und Dampfdruck
Was ist Ausgasung?
Alle Materialien haben Gasmoleküle, die adsorbiert (an der Oberfläche haften) oder absorbiert (im Material eingeschlossen) sind. In einem Vakuum entweichen diese Moleküle allmählich von den Oberflächen.
Dieser Prozess wird Ausgasung genannt. Der Hauptverursacher in den meisten Vakuumsystemen ist Wasserdampf, aber auch Öle, Lösungsmittel und während der Herstellung eingeschlossene Gase tragen dazu bei.
Wie Temperatur die Ausgasung antreibt
Das Erhitzen der Wände der Vakuumkammer überträgt thermische Energie auf die eingeschlossenen Moleküle. Diese erhöhte Energie ermöglicht es ihnen, die Kräfte zu überwinden, die sie an der Oberfläche halten, wodurch sie in das Vakuum freigesetzt werden.
Eine höhere Temperatur bedeutet eine deutlich höhere Ausgasungsrate, was direkt zu einem höheren Druck führt.
Die Rolle des Dampfdrucks
Für jede kondensierte Substanz, wie einen Wassertropfen oder einen Ölfilm in der Kammer, gibt es einen Dampfdruck. Dies ist der Druck, bei dem die Substanz bei einer bestimmten Temperatur im Gleichgewicht mit ihrem eigenen Gas steht.
Mit steigender Temperatur steigt der Dampfdruck dieser Verunreinigungen exponentiell an. Wenn der Dampfdruck der Verunreinigung den Druck in der Kammer übersteigt, verdampft sie schnell, was zu einem dramatischen Druckanstieg führt.
Die praktischen Auswirkungen verstehen
Das „Ausheizen“-Verfahren
Ingenieure nutzen diese Temperatur-Druck-Beziehung, um Ultrahochvakuum (UHV) zu erreichen. Ein System wird oft über viele Stunden oder Tage auf Hunderte von Grad Celsius erhitzt, während die Pumpen laufen.
Dieses „Ausheizen“ beschleunigt die Ausgasung dramatisch, treibt eingeschlossenes Wasser und andere Verunreinigungen ab, sodass die Pumpen sie dauerhaft entfernen können. Nachdem das System wieder abgekühlt ist, ist die Ausgasungsrate erheblich geringer, was ein viel tieferes Vakuum ermöglicht.
Der Einfluss der Kryotechnik
Der gegenteilige Effekt wird ebenfalls genutzt. Extrem kalte Oberflächen, bekannt als Kryofallen oder Kryopumpen, wirken als Senken für Gasmoleküle.
Wenn ein Molekül wie Wasser auf eine sehr kalte Oberfläche trifft, gefriert es sofort und sein Dampfdruck wird vernachlässigbar. Dies entfernt es effektiv aus dem Vakuum und senkt den Systemdruck dramatisch.
Das Problem der Kontamination
Dieses Prinzip verdeutlicht, warum Sauberkeit in der Vakuumtechnologie von größter Bedeutung ist. Ein einziger Fingerabdruck enthält Öle und Wasser, die eine erhebliche Ausgasungsquelle darstellen und den letztendlich erreichbaren Druck eines Systems begrenzen, insbesondere wenn es erhitzt wird.
Die richtige Wahl für Ihr Ziel treffen
Um ein Vakuumsystem effektiv zu verwalten, müssen Sie die Temperatur als primäre Steuergröße behandeln.
- Wenn Ihr Hauptaugenmerk auf der Erzielung des tiefstmöglichen Vakuums liegt: Sie müssen die Kammer während des Pumpens in einem „Ausheiz“-Verfahren erhitzen, um eingeschlossene Gase auszutreiben, und sie dann abkühlen lassen, um den Zieldruck zu erreichen.
- Wenn Ihr Hauptaugenmerk auf der Aufrechterhaltung eines stabilen Vakuums während eines Prozesses liegt: Sie müssen eine präzise Temperaturkontrolle gewährleisten, da selbst kleine thermische Schwankungen aufgrund sich ändernder Ausgasungsraten Druckänderungen verursachen.
- Wenn Ihr Hauptaugenmerk auf dem Umgang mit Substanzen mit hohem Dampfdruck liegt: Möglicherweise müssen Sie kryogene Kühlung (Kühlfallen) verwenden, um Dämpfe einzufangen und zu verhindern, dass sie Ihre Pumpen überlasten.
Letztendlich bedeutet die Beherrschung des Drucks in Ihrem Vakuumsystem die Beherrschung der thermischen Energie seiner Oberflächen.
Zusammenfassungstabelle:
| Temperaturänderung | Auswirkung auf den Vakuumdruck | Primäre Ursache |
|---|---|---|
| Erhöhung | Druck steigt | Beschleunigte Ausgasung und höherer Dampfdruck von Verunreinigungen. |
| Verringerung | Druck sinkt | Reduzierte Ausgasungsrate; kryogene Oberflächen können Moleküle einfangen. |
Haben Sie Probleme mit Druckinstabilität oder können Sie Ihr Zielvakuum nicht erreichen? Das Wärmemanagement Ihres Systems ist wahrscheinlich der Schlüssel. KINTEK ist spezialisiert auf Laborgeräte und Verbrauchsmaterialien für präzise Vakuumanwendungen. Unsere Experten können Ihnen bei der Auswahl der richtigen Komponenten und der Entwicklung von Protokollen für Ausheizen, Temperaturregelung oder kryogenes Einfangen helfen, um sicherzustellen, dass Ihre Vakuumprozesse zuverlässig und wiederholbar sind. Kontaktieren Sie noch heute unsere Vakuumspezialisten, um die Leistung Ihres Systems zu optimieren.
Visuelle Anleitung
Ähnliche Produkte
- Beheizte Hydraulikpressmaschine mit beheizten Platten für Vakuumbox-Labor-Heißpresse
- Elektrische hydraulische Vakuum-Heizpresse für Laboratorien
- Vakuumwärmebehandlungsöfen mit Keramikfaser-Auskleidung
- Manuelle Hochtemperatur-Heizpresse mit beheizten Platten für das Labor
- Molybdän-Vakuumwärmebehandlungsöfen
Andere fragen auch
- Wie hoch ist die Temperatur bei der Vakuumwärmebehandlung? Erzielen Sie überlegene Materialeigenschaften und makellose Oberflächen
- Welche Rolle spielt ein Hochtemperatur-Sinterofen bei der Herstellung von NZSP? Schlüssel zur optimalen Ionenleitfähigkeit
- Was sind die Vorteile der Vakuumhärtung? Makellose Oberflächen und unübertroffene Präzision erreichen
- Wie wird ein Vakuumofen bei der Herstellung von Gelpolymer-Elektrolyt (GPE)-Membranen verwendet? Meistern Sie Ihre Batterieforschung
- Wie verändert das Glühen die Eigenschaften eines Metalls? Wiederherstellung der Verarbeitbarkeit und Verbesserung der Leistung
- Was ist ein Niedertemperaturvakuum? Das ultimative Werkzeug zur Erreichung von Ultrahochvakuum
- In welchen Branchen wird Löten hauptsächlich eingesetzt? Ein Leitfaden für hochfeste Verbindungen in der Luft- und Raumfahrt, der Automobilindustrie und mehr
- Was ist Entbindern (Debinding) im 3D-Druck? Der wesentliche Schritt für stabile Metall- und Keramikteile



















