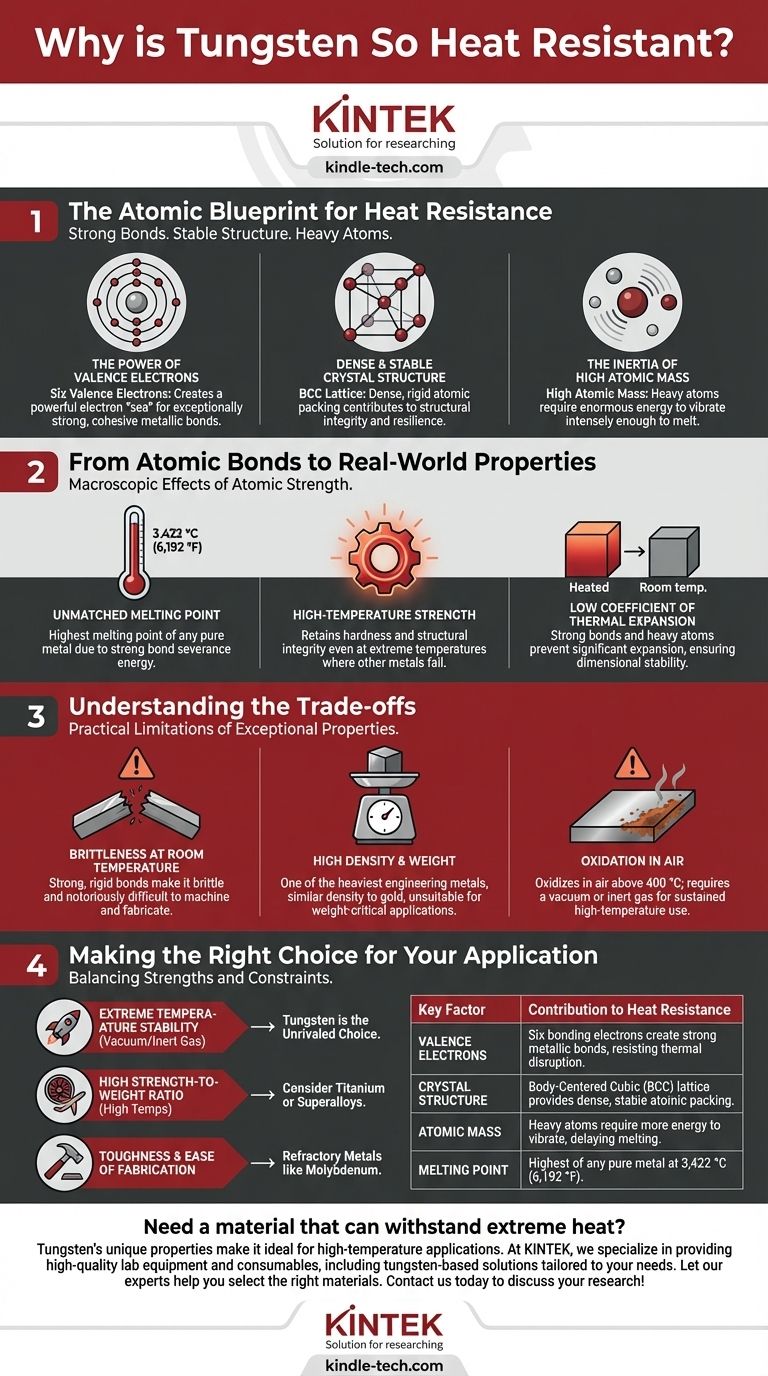
Die außergewöhnliche Hitzebeständigkeit von Wolfram ist ein direktes Ergebnis der starken metallischen Bindungen, die seine Atome in einer hochstabilen Kristallstruktur zusammenhalten. Diese atomare Konfiguration erfordert eine immense Menge an thermischer Energie, um gestört zu werden, was Wolfram mit 3.422 °C (6.192 °F) den höchsten Schmelzpunkt aller reinen Metalle verleiht. Seine schweren Atome und die dichte Packung tragen zusätzlich zu dieser Stabilität bei.
Der Widerstand eines Metalls gegen Hitze wird fundamental durch die Stärke seiner interatomaren Bindungen bestimmt. Wolfram zeichnet sich aus, weil seine Atomstruktur mit einer hohen Anzahl von Bindungselektronen und einem dichten Kristallgitter unglaublich starke Bindungen erzeugt, die enorme Energie zum Aufbrechen erfordern.

Der atomare Bauplan für Hitzebeständigkeit
Um die Eigenschaften von Wolfram zu verstehen, müssen wir uns sein Design auf atomarer Ebene ansehen. Seine einzigartige Kombination aus Elektronen, Kristallstruktur und Atommasse schafft eine Festung gegen thermische Energie.
Die Kraft der Valenzelektronen
Wolfram ist ein Übergangsmetall mit sechs Valenzelektronen, den äußersten Elektronen, die an der chemischen Bindung beteiligt sind.
Bei einer metallischen Bindung sind diese Valenzelektronen delokalisiert und bilden ein gemeinsames „Meer“ von Elektronen, das als starker Klebstoff wirkt und die positiv geladenen Atomkerne zusammenhält.
Mit sechs Bindungselektronen pro Atom erzeugt Wolfram deutlich mehr von diesem „Klebstoff“ als Metalle wie Aluminium (drei Valenzelektronen) oder Natrium (eins). Dies führt zu außergewöhnlich starken, kohäsiven Bindungen.
Eine dichte und stabile Kristallstruktur
Wolframatome ordnen sich in einem kubisch-raumzentrierten (KRZ) Gitter an. Diese Struktur besteht aus einem Atom an jeder Ecke eines Würfels und einem Atom in der Mitte.
Die KRZ-Anordnung ist eine dichte und sehr stabile Art, Atome zu packen. Diese enge Packung, kombiniert mit den starken metallischen Bindungen, erzeugt ein starres und widerstandsfähiges Atomgitter.
Die Trägheit der hohen Atommasse
Wolfram ist ein sehr schweres Element mit einer hohen Atommasse. Wenn einem Material thermische Energie zugeführt wird, beginnen seine Atome zu vibrieren.
Schwerere Atome haben mehr Trägheit und vibrieren bei gleicher Energiemenge langsamer als leichtere Atome. Es wird einfach mehr Energie benötigt, um schwere Wolframatome stark genug vibrieren zu lassen, um sich aus ihren Gitterpositionen zu lösen und zu schmelzen.
Von atomaren Bindungen zu realen Eigenschaften
Diese atomaren Eigenschaften übertragen sich direkt auf die makroskopischen Eigenschaften, die Wolfram zu einem erstklassigen Hochtemperaturmaterial machen.
Unübertroffener Schmelzpunkt
Schmelzen ist der Prozess, bei dem Atomen genügend Energie zugeführt wird, um ihre Bindungen zu lösen und sich frei als Flüssigkeit zu bewegen. Da die metallischen Bindungen von Wolfram so stark sind, ist eine außergewöhnliche Energiemenge erforderlich, um sie zu durchtrennen, was zum höchsten Schmelzpunkt aller Metalle führt.
Hohe Festigkeit bei hohen Temperaturen
Die gleichen Bindungen, die dem Schmelzen widerstehen, widerstehen auch der Verformung. Selbst bei Temperaturen, bei denen andere Metalle erweichen und versagen würden, behält Wolfram dank seines starren Atomgitters seine Härte und strukturelle Integrität.
Geringer Wärmeausdehnungskoeffizient
Die starken Bindungen und schweren Atome halten die Struktur in einer engen, starren Konfiguration. Beim Erhitzen vibrieren die Atome, sind aber so fest an ihrem Platz gehalten, dass sich das Gesamtmaterial nicht wesentlich ausdehnt. Diese Dimensionsstabilität ist entscheidend für Präzisionskomponenten in Umgebungen mit hohen Temperaturen.
Die Abwägungen verstehen
Kein Material ist perfekt. Genau die Eigenschaften, die Wolfram bei der Hitzebeständigkeit auszeichnen, führen auch zu praktischen Einschränkungen.
Sprödigkeit bei Raumtemperatur
Die extrem starken und starren Atombindungen, die die Festigkeit bei hohen Temperaturen gewährleisten, machen reines Wolfram bei Raumtemperatur auch spröde. Das Gitter widersteht dem Biegen, daher bricht es unter Belastung eher, als sich plastisch zu verformen. Dies macht die Bearbeitung und Fertigung notorisch schwierig.
Hohe Dichte und Gewicht
Die Kombination aus schweren Atomen und einer dichten KRZ-Struktur macht Wolfram zu einem der schwersten Konstruktionsmetalle mit einer Dichte, die mit der von Gold vergleichbar ist. Dieses extreme Gewicht macht es für Anwendungen ungeeignet, bei denen das Gewicht die Hauptsorge ist, wie z. B. bei den meisten strukturellen Komponenten in der Luft- und Raumfahrt.
Oxidation an der Luft
Obwohl sein Schmelzpunkt unglaublich hoch ist, beginnt Wolfram bei Temperaturen über 400 °C in der Luft zu oxidieren (mit Sauerstoff zu reagieren). Für einen dauerhaften Einsatz bei hohen Temperaturen muss es durch ein Vakuum oder eine inerte Gasatmosphäre geschützt werden, wie z. B. in einer Glühlampe oder einem WIG-Schweißbrenner.
Die richtige Wahl für Ihre Anwendung treffen
Die Auswahl eines Materials erfordert eine Abwägung seiner außergewöhnlichen Stärken gegenüber seinen inhärenten Einschränkungen. Ihr Endziel bestimmt, ob Wolfram die richtige Wahl ist.
- Wenn Ihr Hauptaugenmerk auf extremer Temperaturstabilität in einem Vakuum oder Inertgas liegt: Wolfram ist die unübertroffene Wahl für Anwendungen wie Vakuumofenelemente, Raketendüsen oder Glühfäden.
- Wenn Ihr Hauptaugenmerk auf einem hohen Verhältnis von Festigkeit zu Gewicht bei hohen Temperaturen liegt: Sie sollten Materialien wie Titanlegierungen oder Nickelbasis-Superlegierungen in Betracht ziehen, die eine bessere Leistung bieten, wenn Gewicht ein kritischer Nachteil ist.
- Wenn Ihr Hauptaugenmerk auf Zähigkeit und einfacher Bearbeitung liegt: Sie wären mit hochschmelzenden Metallen wie Molybdän oder Niob besser bedient, die einen Kompromiss zwischen Hitzebeständigkeit und verbesserter Duktilität bieten.
Indem Sie die atomaren Ursprünge der Wolfram-Eigenschaften verstehen, können Sie seine unglaubliche Hitzebeständigkeit effektiv nutzen und gleichzeitig seine praktischen Einschränkungen berücksichtigen.
Zusammenfassungstabelle:
| Wichtiger Faktor | Beitrag zur Hitzebeständigkeit |
|---|---|
| Valenzelektronen | Sechs Bindungselektronen erzeugen starke metallische Bindungen, die thermischer Störung widerstehen. |
| Kristallstruktur | Kubisch-raumzentriertes (KRZ) Gitter sorgt für dichte, stabile Atompackung. |
| Atommasse | Schwere Atome benötigen mehr Energie zum Vibrieren, was das Schmelzen verzögert. |
| Schmelzpunkt | Höchster aller reinen Metalle bei 3.422 °C (6.192 °F). |
Benötigen Sie ein Material, das extremer Hitze standhält? Die einzigartigen Eigenschaften von Wolfram machen es ideal für Hochtemperaturanwendungen wie Ofenkomponenten, Raketendüsen und Schweißelektroden. Bei KINTEK sind wir spezialisiert auf die Bereitstellung hochwertiger Laborgeräte und Verbrauchsmaterialien, einschließlich Wolfram-basierter Lösungen, die auf die spezifischen Bedürfnisse Ihres Labors zugeschnitten sind. Lassen Sie sich von unseren Experten bei der Auswahl der richtigen Materialien für Ihre Hochtemperaturanforderungen helfen. Kontaktieren Sie uns noch heute, um zu besprechen, wie wir Ihre Forschungs- und Industrieprozesse unterstützen können!
Visuelle Anleitung
Ähnliche Produkte
- Hochreine Gold-, Platin-, Kupfer- und Eisenmetallbleche
- Hochtemperatur-verschleißfeste Aluminiumoxid-Al2O3-Platte für technische fortschrittliche Fein keramiken
- Manuelle Hochtemperatur-Heizpresse mit beheizten Platten für das Labor
- Zirkonoxid-Keramikdichtung Technische Keramik
- Kundenspezifischer PTFE-Teflon-Teilehersteller für PTFE-Maschensieb F4
Andere fragen auch
- Was verursacht das Versagen von Heizelementen? Vermeiden Sie Ausfallzeiten, indem Sie den Degradationsprozess verstehen
- Was sind die technischen Vorteile der Verwendung von Graphitstäben? Steigern Sie die Präzision bei Hochtemperaturbetrieben von 1200 °C
- Warum wird Wolfram in Öfen verwendet? Unübertroffene Hitzebeständigkeit für extreme Temperaturen
- Was ist ein Sinterelement? Ein Leitfaden zu technischer Porosität und komplexen Formen
- Wie heizt sich ein Heizelement auf? Die Wissenschaft der Jouleschen Wärme einfach erklärt
- Was ist ein Thermoelement und wie funktioniert es in einem Sinterofen? Beherrschen Sie präzise Hochtemperaturkontrolle
- Was ist eine Graphitheizung? Erreichen Sie überlegene Temperaturuniformität und -stabilität
- Gibt es verschiedene Arten von Heizelementen? Wählen Sie die richtige Heizung für Ihre Anwendung



















