Auslegungskriterien für elektrolytische Zellen
Volumen einer Elektrolysezelle
Das Volumen einer Elektrolysezelle spielt eine entscheidende Rolle bei der Bestimmung der Effizienz und Genauigkeit elektrochemischer Prozesse. Das optimale Zellvolumen hängt davon ab, dass ein angemessenes Verhältnis zwischen der Arbeitselektrode und dem Lösungsvolumen eingehalten wird. Dieses Verhältnis ist nicht statisch, sondern variiert je nach Art der durchgeführten Messung oder Prüfung erheblich.
So wird beispielsweise bei hochpräzisen analytischen Messungen häufig ein kleineres Zellvolumen mit einem höheren Verhältnis zwischen Elektrode und Lösung bevorzugt. Diese Konfiguration minimiert die Dicke der Diffusionsschicht und erhöht damit die Empfindlichkeit und Genauigkeit der Messwerte. Umgekehrt kann bei industriellen Anwendungen, bei denen es um die Herstellung von Metallen in großem Maßstab geht, ein größeres Zellvolumen mit einem niedrigeren Elektroden-Lösungs-Verhältnis erforderlich sein, um den erhöhten Durchsatz und die betrieblichen Anforderungen zu erfüllen.
| Art der Messung | Bevorzugtes Zellvolumen | Elektrode-zu-Lösung-Verhältnis |
|---|---|---|
| Hochpräzise Analyse | Klein | Hoch (z. B. 1:10) |
| Industrielle Metallproduktion | Groß | Niedrig (z. B. 1:100) |
Das Verständnis und die Optimierung dieses Verhältnisses ist entscheidend für die Erzielung der gewünschten Ergebnisse bei verschiedenen elektrochemischen Anwendungen.
Material für elektrolytische Zellen
Bei der Auswahl von Materialien für Elektrolysezellen gibt es zwei Hauptoptionen: Glas und Polytetrafluorethylen (PTFE). Jedes Material hat seine eigenen Vorteile und Einschränkungen, die je nach Anwendung und Umgebungsbedingungen sorgfältig abgewogen werden müssen.
Insbesondere PTFE ist für seine außergewöhnliche Stabilität bekannt, vor allem in rauen Umgebungen wie konzentriertem Alkali und Königswasser. Diese Stabilität ist von entscheidender Bedeutung für die Aufrechterhaltung der Integrität und Effizienz des elektrolytischen Prozesses, insbesondere in industriellen Umgebungen, in denen ein längerer Kontakt mit korrosiven Substanzen unvermeidlich ist. Die Inertheit von PTFE sorgt dafür, dass es nicht mit dem Elektrolyten oder anderen Zellkomponenten reagiert, wodurch mögliche Störungen minimiert und die Lebensdauer der Zelle verlängert werden.
Andererseits bietet Glas seine eigenen Vorteile, insbesondere bei Anwendungen, bei denen Transparenz für die Überwachung des elektrolytischen Prozesses unerlässlich ist. Seine Korrosionsanfälligkeit in stark alkalischen Umgebungen schränkt jedoch seine Verwendung in bestimmten Kontexten ein. Trotzdem ist Glas aufgrund seiner Kosteneffizienz und einfachen Herstellung nach wie vor eine beliebte Wahl für Experimente im Labormaßstab und für Demonstrationen in der Ausbildung.

Zusammenfassend lässt sich sagen, dass die Wahl zwischen Glas und PTFE von den spezifischen Anforderungen des elektrolytischen Prozesses abhängt, einschließlich der chemischen Umgebung, der Langlebigkeit des Betriebs und der Kostenüberlegungen.
Diaphragma für elektrolytische Zellen
Das Diaphragma in einer Elektrolysezelle hat eine wichtige Funktion bei der Trennung der Arbeitselektrode von der Hilfselektrode. Eines der am häufigsten verwendeten Materialien für diesen Zweck ist poröses Glas. Diese Wahl ist nicht willkürlich; poröses Glas bietet mehrere Vorteile, die die Leistung und Genauigkeit des elektrolytischen Prozesses verbessern.
Erstens gewährleistet poröses Glas gleichmäßige Stromverteilung in der gesamten Zelle. Diese Gleichmäßigkeit ist für die Aufrechterhaltung konsistenter und zuverlässiger Messungen unerlässlich. Indem poröses Glas einen gleichmäßigen Weg für den Stromfluss bietet, trägt es dazu bei, Schwankungen und Fehler in den erfassten Daten zu minimieren.
Zweitens werden durch die Verwendung von porösem Glas als Diaphragma die Interferenzen Störungen durch die Hilfselektrode. In Elektrolysezellen können die an der Hilfselektrode erzeugten Produkte manchmal in die Umgebung der Arbeitselektrode diffundieren, was zu unerwünschten Reaktionen führt und die Ergebnisse verfälscht. Die feinen Poren des Glases wirken wie eine Barriere, die eine solche Kreuzkontamination verhindert und die Integrität der Umgebung der Arbeitselektrode bewahrt.
Außerdem ist poröses Glas sehr resistent gegen chemische Angriffe und eignet sich daher für den Einsatz in einer Vielzahl von Elektrolytlösungen. Diese chemische Stabilität gewährleistet, dass das Diaphragma auch unter rauen Bedingungen über lange Zeiträume hinweg wirksam bleibt.
Zusammenfassend lässt sich sagen, dass die Wahl von porösem Glas als Diaphragmamaterial auf seiner Fähigkeit beruht, eine gleichmäßige Stromverteilung zu gewährleisten, Interferenzen zu reduzieren und die chemische Stabilität aufrechtzuerhalten, was alles entscheidend für den genauen und zuverlässigen Betrieb von Elektrolysezellen ist.
Elektrolyt
Inerte Elektrolyte spielen bei der Konstruktion von Elektrolysezellen eine zentrale Rolle, vor allem um die Migration aktiver Substanzen zu verhindern, die andernfalls die beabsichtigten chemischen Reaktionen beeinträchtigen könnten. Die Konzentration dieser inerten Elektrolyte muss deutlich höher sein als die der aktiven Substanzen, um ihre Wirksamkeit zu gewährleisten. In der Regel sollte die Konzentration mindestens 100-mal höher sein als die des Wirkstoffs. Diese hohe Konzentration wirkt wie eine Barriere, die das Potenzial für Kreuzkontaminationen minimiert und die Stabilität und Zuverlässigkeit des elektrolytischen Prozesses gewährleistet.
In der industriellen Metallproduktion beispielsweise, wo eine genaue Kontrolle der chemischen Reaktionen von entscheidender Bedeutung ist, wird durch die Verwendung inerter Elektrolyte sichergestellt, dass die Primärreaktionen nicht durch die Anwesenheit anderer reaktiver Spezies beeinträchtigt werden. Dieses hohe Konzentrationsverhältnis stabilisiert nicht nur die elektrolytische Umgebung, sondern erhöht auch die Effizienz des Prozesses und verringert die Wahrscheinlichkeit unerwünschter Nebenreaktionen. Daher sind die sorgfältige Auswahl und das Management von inerten Elektrolyten wesentliche Komponenten bei der Konstruktion und dem Betrieb von Elektrolysezellen.
Entlüftungsvorrichtung für elektrolytische Zellen
Einlass- und Auslasskanäle sind wesentliche Bestandteile einer Elektrolysezelle, die die Desoxygenierung und Gasadsorption erleichtern sollen. Die Konfiguration dieser Kanäle ist entscheidend für die Aufrechterhaltung der Effizienz und Sicherheit des elektrolytischen Prozesses. In der Regel ist der Einlass strategisch am Boden der Zelle platziert, um sicherzustellen, dass das einströmende Gas gleichmäßig über den Elektrolyten verteilt wird. Diese Platzierung am Boden der Zelle trägt dazu bei, dass sich die Gase gründlich mit dem Elektrolyten vermischen, was eine effektive Desoxygenierung fördert.
Der Auslass hingegen ist mit einem Wasserdichtungsmechanismus ausgestattet. Diese Wasserdichtung dient mehreren Zwecken: Sie verhindert den Rückfluss von Gas aus dem Auslass, sorgt für eine kontrollierte Freisetzung von Gasen und hält den Druck innerhalb der Zelle stabil. Durch die Wasserdichtung kann die Elektrolysezelle unter optimalen Bedingungen arbeiten, wodurch das Risiko eines Gasaustritts verringert und sichergestellt wird, dass die Umgebung innerhalb der Zelle stabil und für den Elektrolyseprozess förderlich bleibt.
Zusammenfassend lässt sich sagen, dass die sorgfältige Gestaltung der Ein- und Auslasskanäle, bei denen sich der Einlass am Boden befindet und der Auslass mit einer Wasserdichtung versehen ist, für eine wirksame Desoxygenierung und Gasadsorption in Elektrolysezellen von entscheidender Bedeutung ist, wodurch die Gesamteffizienz und Sicherheit des Prozesses verbessert wird.
Salzbrücke für elektrolytische Zellen
Die Salzbrücke ist ein wesentlicher Bestandteil von Elektrolysezellen und dient als Verbindungsleitung zwischen den Referenz- und den Forschungselektroden. Diese Verbindung ist entscheidend für die Aufrechterhaltung der elektrischen Neutralität innerhalb der Zelle, wodurch der reibungslose Fluss der Ionen erleichtert und der Stromkreis geschlossen wird. Die Salzbrücke besteht in der Regel aus einem starken Elektrolyten wie Natriumchlorid oder Kaliumnitrat, der in einem U-förmigen Glasrohr untergebracht oder in porösem Material wie Filterpapier getränkt ist.
Eine der Hauptfunktionen der Salzbrücke ist die Abschwächung des Flüssigkeits-Kontaktpotenzials, ein Phänomen, das auftritt, wenn zwei verschiedene Elektrolyte in Kontakt kommen, was zu einer Potenzialdifferenz führt. Indem sichergestellt wird, dass die Elektrolytlösung in der Salzbrücke inert und nicht reaktiv mit anderen Lösungen ist, wird das Risiko unerwünschter chemischer Reaktionen minimiert. Diese Inertheit ermöglicht die ungehinderte Bewegung von Ionen zwischen den beiden Halbzellen, wodurch eine gleichmäßige Ladungsverteilung aufrechterhalten und eine Kontamination verhindert wird.
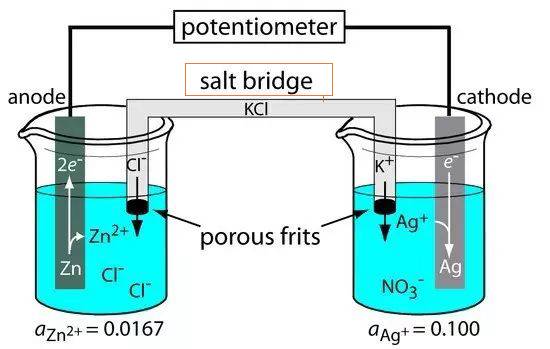
Es gibt zwei gängige Arten von Salzbrücken: die Glasrohrbrücke und die Filterpapierbrücke. Bei der Glasrohrbrücke handelt es sich, wie der Name schon sagt, um ein U-förmiges Rohr, das mit Elektrolyten gefüllt ist, während bei der Filterpapierbrücke poröses Filterpapier verwendet wird, das mit Elektrolytlösungen getränkt ist. Beide Arten dienen demselben Zweck, unterscheiden sich aber in ihrer physikalischen Struktur und ihrer Benutzerfreundlichkeit.
In praktischen Anwendungen, wie z. B. beim Bau von galvanischen oder voltaischen Zellen, spielt die Salzbrücke eine zentrale Rolle. Wenn Elektronen durch einen äußeren Stromkreis von einer Halbzelle zur anderen fließen, entsteht eine Ladungsdifferenz. Ohne die Salzbrücke würde dieser Ladungsunterschied den Elektronenfluss schnell zum Erliegen bringen. Die Salzbrücke ermöglicht die kontinuierliche Bewegung von Ionen und sorgt dafür, dass die Ladungsverteilung stabil bleibt und die Zelle effizient arbeitet.
Zusammenfassend lässt sich sagen, dass die Salzbrücke ein entscheidendes Element in Elektrolysezellen ist, da sie den nahtlosen Fluss der Ionen ermöglicht und die elektrische Neutralität aufrechterhält. Ihr Design und ihre Zusammensetzung werden sorgfältig ausgewählt, um unerwünschte Reaktionen zu verhindern und die Integrität des elektrochemischen Prozesses zu gewährleisten.
Rukin-Kapillarrohr für elektrolytische Zellen
Das Rukin-Kapillarrohr spielt eine zentrale Rolle bei der Konstruktion von Elektrolysezellen, insbesondere bei der Aufrechterhaltung eines minimalen Widerstands zwischen der Referenz- und der Arbeitselektrode. Diese kritische Eigenschaft ist für eine präzise Potenzialsteuerung unerlässlich, die für die Genauigkeit und Zuverlässigkeit von elektrolytischen Prozessen von grundlegender Bedeutung ist.
Schlüsselfunktionen des Rukin-Kapillarrohrs
-
Minimaler Widerstand: Die Hauptfunktion des Rukin-Kapillarröhrchens besteht darin, den elektrischen Widerstand zwischen der Referenz- und der Arbeitselektrode auf ein absolutes Minimum zu reduzieren. Dies wird durch die Konstruktion der Röhre erreicht, die eine effiziente elektrische Leitfähigkeit ohne nennenswerte Verluste oder Störungen ermöglicht.
-
Präzise Potentialkontrolle: Durch den minimalen Widerstand ermöglicht das Rukin-Kapillarröhrchen eine genauere Kontrolle der Potentialdifferenz zwischen den Elektroden. Diese Präzision ist für verschiedene elektrolytische Anwendungen von entscheidender Bedeutung, von der industriellen Metallproduktion bis hin zur wissenschaftlichen Forschung, bei der schon geringe Abweichungen im Potenzial zu erheblichen Fehlern führen können.
-
Verbesserte Stabilität: Das Design des Rukin-Kapillarrohrs trägt auch zur Gesamtstabilität der Elektrolysezelle bei. Indem es die Wahrscheinlichkeit von Potenzialschwankungen verringert, trägt es zur Aufrechterhaltung einer gleichmäßigen und stabilen Umgebung für den elektrolytischen Prozess bei.
Überlegungen zu Material und Design
-
Auswahl des Materials: Das Rukin-Kapillarrohr wird in der Regel aus Materialien hergestellt, die eine hohe elektrische Leitfähigkeit und chemische Beständigkeit aufweisen, wie z. B. Platin oder Gold. Diese Materialien stellen sicher, dass das Rohr den rauen Bedingungen elektrolytischer Prozesse standhalten kann, ohne sich zu zersetzen.
-
Geometrie des Rohrs: Die Geometrie des Rukin-Kapillarrohrs wurde sorgfältig entwickelt, um den Stromfluss zu optimieren. Dazu gehören Überlegungen zur Rohrlänge, zum Durchmesser und zur Platzierung der Ein- und Auslasskanäle, die alle dazu beitragen, den Widerstand zu minimieren und die Leitfähigkeit zu verbessern.
Zusammenfassend lässt sich sagen, dass das Rukin-Kapillarrohr eine unverzichtbare Komponente bei der Konstruktion von Elektrolysezellen ist, da es eine robuste Lösung zur Gewährleistung eines minimalen Widerstands und einer präzisen Potenzialsteuerung bietet. Die sorgfältige Materialauswahl und das optimierte Design machen es zu einem Schlüsselelement für zuverlässige und genaue elektrolytische Ergebnisse.
Typen von elektrolytischen Zellen
Einkammer-Elektrolysezelle
Einkammer-Elektrolysezellen sind speziell für Korrosionsuntersuchungen konzipiert, bei denen sowohl die Forschungs- als auch die Hilfselektroden in derselben Kammer untergebracht sind. Diese Konfiguration vereinfacht den Aufbau, da keine komplexe Unterteilung der Kammern erforderlich ist, und ist somit die ideale Wahl für Forscher, die sich auf Korrosionsmechanismen konzentrieren.

Die unmittelbare Nähe der Forschungs- und Hilfselektroden ermöglicht die Überwachung von Korrosionsprozessen in Echtzeit. Dies ist besonders vorteilhaft bei Studien, bei denen schnelle Änderungen des Elektrodenpotenzials beobachtet werden, da die Zeitspanne zwischen den Messungen minimiert wird. Darüber hinaus verringert das Einkammerdesign das Risiko einer Verunreinigung, die bei getrennten Kammern auftreten könnte, und gewährleistet eine genauere und konsistentere Datenerfassung.
Außerdem erleichtert die Verwendung einer einzigen Kammer die Kontrolle der elektrolytischen Umgebung. Die Forscher können die Elektrolytzusammensetzung und -konzentration sowie die Temperatur und den Druck innerhalb der Kammer genau einstellen, um verschiedene Korrosionsbedingungen zu simulieren. Diese Anpassungsfähigkeit ist entscheidend für das Verständnis, wie verschiedene Faktoren die Korrosionsraten und -muster beeinflussen.
Trotz seiner Vorteile hat der Einkammeraufbau auch seine Grenzen. Das Fehlen eines Diaphragmas bedeutet zum Beispiel, dass es keine physische Barriere gibt, die die Produkte der Forschungselektrode von denen der Hilfselektrode trennt. Dies kann zu potenziellen Interferenzen bei den Messungen führen, insbesondere bei Studien mit hochreaktiven oder flüchtigen Substanzen. Daher ist das Einkammerdesign zwar für viele Korrosionsstudien praktisch, aber nicht für alle Versuchsbedingungen geeignet.
Zweikammer-Elektrolysezelle
Die Zweikammer-Elektrolysezelle ist so konzipiert, dass Störungen durch Produkte der Hilfselektrode durch ein Diaphragma, das die Arbeitselektrode von der Hilfselektrode trennt, gemildert werden. Diese Konfiguration ist besonders vorteilhaft, um Kreuzkontaminationen zu reduzieren und präzisere Messungen zu gewährleisten.

Hauptmerkmale und Vorteile
- Material des Diaphragmas: Das Diaphragma, das in der Regel aus porösem Glas besteht, ermöglicht den Durchgang von Ionen und verhindert gleichzeitig den direkten Kontakt von Elektrodenprodukten, wodurch die Integrität der Arbeitsumgebung gewahrt bleibt.
- Gleichmäßige Stromverteilung: Das Diaphragma sorgt für eine gleichmäßige Stromverteilung in der Elektrolysezelle, was für konsistente und zuverlässige Ergebnisse unerlässlich ist.
- Reduzierte Interferenzen: Durch die Isolierung der Arbeitselektrode von der Hilfselektrode reduziert das Doppelkammerdesign das Potenzial für Interferenzen erheblich und verbessert so die Genauigkeit der erfassten Daten.
Anwendungen und Vorteile
- Korrosionsuntersuchungen: Der Doppelkammeraufbau ist besonders vorteilhaft bei Korrosionsstudien, bei denen die Reinheit der Arbeitselektrode entscheidend ist.
- Präzise Messungen: Für Anwendungen, die eine hohe Präzision erfordern, wie z. B. in der analytischen Chemie, bietet die Zweikammerzelle eine kontrollierte Umgebung, die äußere Einflüsse minimiert.
Dieses Design verbessert nicht nur die Genauigkeit der Messungen, sondern verlängert auch die Lebensdauer der Elektroden, da die Exposition gegenüber potenziell schädlichen Nebenprodukten reduziert wird.
Elektrolyse-Typen auf der Grundlage der Produkterzeugung
Elektrolyse von Wasser
Die Elektrolyse von Wasser ist ein grundlegender Prozess, der unter bestimmten Bedingungen abläuft, hauptsächlich mit sauerstoffhaltige Säuren , starken Basen und sauerstoffhaltige Salzlösungen aktiver Metalle . Diese Art der Elektrolyse ist durch die Zersetzung von Wassermolekülen in Wasserstoff- und Sauerstoffgase gekennzeichnet, eine Reaktion, die sowohl wissenschaftlich faszinierend als auch industriell bedeutsam ist.
Um die Wasserelektrolyse zu verstehen, muss man sich zunächst mit der Art der beteiligten Elektrolyte befassen. Sauerstoffhaltige Säuren wie Salpetersäure (HNO₃) und Schwefelsäure (H₂SO₄), enthalten an das Zentralatom gebundene Sauerstoffatome, was die Freisetzung von Sauerstoff während des Elektrolyseprozesses erleichtert. Ähnliches gilt für, starke Basen wie Natriumhydroxid (NaOH) und Kaliumhydroxid (KOH) eine stark alkalische Umgebung, die die Dissoziation von Wassermolekülen fördert.

Im Zusammenhang mit sauerstoffhaltigen sauren Salzlösungen von aktiven Metallen wie Natriumnitrat (NaNO₃) oder Kaliumsulfat (K₂SO₄), erhöht das Vorhandensein aktiver Metalle wie Natrium (Na) oder Kalium (K) die Leitfähigkeit der Lösung und erleichtert so den Elektrolyseprozess. Diese Salze bilden, wenn sie in Wasser gelöst sind, ein leitfähiges Medium, in dem die aktiven Metalle als Ladungsträger fungieren und den für die Elektrolyse erforderlichen Elektronenfluss unterstützen.
Die Elektrolyse von Wasser ist nicht nur ein Schlüsselprozess für verschiedene industrielle Anwendungen, wie z. B. die Herstellung von Wasserstoffgas für Brennstoffzellen, sondern dient auch als grundlegendes Konzept in der Elektrochemie. Das Verständnis der spezifischen Bedingungen, unter denen dieser Prozess abläuft - ob in Gegenwart von sauerstoffhaltigen Säuren, starken Basen oder sauerstoffhaltigen sauren Salzlösungen aktiver Metalle - ist entscheidend für die Optimierung der Konstruktion von Elektrolysezellen und die Gewährleistung einer effizienten Energieumwandlung.
Zersetzung der Elektrolytart
Die Zersetzung des Elektrolyttyps ist ein spezifischer Prozess, der unter bestimmten Bedingungen auftritt, insbesondere bei sauerstofffreien Säuren und Lösungen mit inaktiven Metallen und sauerstofffreien Salzen. Diese Art der Elektrolyse unterscheidet sich von anderen durch das Fehlen von Sauerstoff, der die chemischen Reaktionen an den Elektroden erheblich beeinflusst.
In sauerstofffreien Umgebungen tragen die Säuren und Salze nicht zur Bildung von Sauerstoffgas bei, das bei vielen Elektrolyseverfahren als Nebenprodukt anfällt. Stattdessen liegt der Schwerpunkt auf der direkten Wechselwirkung zwischen dem Elektrolyten und den Elektroden, die zur Zersetzung des Elektrolyten selbst führt. Dieser Prozess ist von entscheidender Bedeutung für industrielle Anwendungen, bei denen die Aufrechterhaltung einer sauerstofffreien Umgebung wichtig ist, um Verunreinigungen zu vermeiden und die Reinheit der Endprodukte zu gewährleisten.
So kann beispielsweise bei der Herstellung bestimmter Metalle durch die Verwendung sauerstofffreier Säuren und Salze die Bildung von Oxiden verhindert werden, die andernfalls die Qualität des Metalls beeinträchtigen könnten. Die Abwesenheit von Sauerstoff vereinfacht auch die Nachbearbeitungsschritte, da sauerstoffbedingte Verunreinigungen nicht aus dem Produkt entfernt werden müssen.
Zusammenfassend lässt sich sagen, dass die Zersetzung des Elektrolyt-Typs dadurch gekennzeichnet ist, dass sie unter sauerstofffreien Bedingungen stattfindet, die nicht nur die chemischen Wege verändern, sondern auch die Effizienz und Reinheit der entstehenden Produkte verbessern.
Wasserstoff freisetzender Alkalityp
Die Alkali-Elektrolyse mit Wasserstofffreisetzung ist ein spezifischer Prozess, der in Gegenwart von aktiven Metallen und anaeroben sauren Lösungen abläuft. Diese Art der Elektrolyse ist durch die Freisetzung von Wasserstoffgas an der Kathode gekennzeichnet, das ein direktes Ergebnis der Reduktion der in der anaeroben sauren Lösung vorhandenen Wasserstoffionen ist. Die aktiven Metalle, bei denen es sich in der Regel um Alkali- oder Erdalkalimetalle handelt, spielen bei diesem Prozess eine entscheidende Rolle, da sie die notwendigen Elektronen für die Reduktionsreaktion bereitstellen.
Die anaerobe Beschaffenheit der sauren Lösung ist wichtig, um die Bildung von Sauerstoffgas zu verhindern, das sonst den Elektrolyseprozess erschweren würde. In einer anaeroben Umgebung sind die Wasserstoffionen die primäre Spezies, die reduziert wird, was zu einer effizienten Produktion von Wasserstoffgas führt. Dieser Prozess ist besonders wichtig für industrielle Anwendungen, bei denen die Erzeugung von Wasserstoffgas ein wichtiges Ziel ist, wie z. B. bei der Herstellung bestimmter Chemikalien oder in der Brennstoffzellentechnologie.
Um diese Art der Elektrolyse zu ermöglichen, muss die Elektrolysezelle unter besonderen Gesichtspunkten konzipiert werden. Häufig wird ein Diaphragma, z. B. aus porösem Glas, verwendet, um die Arbeitselektrode von der Hilfselektrode zu trennen und so eine gleichmäßige Stromverteilung zu gewährleisten und Störungen durch Produkte der Hilfselektrode zu minimieren. Außerdem sollte die Elektrolytkonzentration sorgfältig kontrolliert werden, um die Migration aktiver Substanzen zu verhindern, die den Elektrolyseprozess beeinträchtigen könnten.
Zusammenfassend lässt sich sagen, dass die Alkali-Wasserstoff-Elektrolyse ein spezielles Verfahren ist, das die Reaktivität aktiver Metalle und die Eigenschaften anaerober saurer Lösungen zur effizienten Erzeugung von Wasserstoffgas nutzt. Die richtige Konstruktion der Elektrolysezelle und die richtige Materialauswahl sind entscheidend für den Erfolg dieses Verfahrens in industriellen Anwendungen.
Art der sauerstoffproduzierenden Säure
Die sauerstofferzeugende Säuretyp der Elektrolyse ist dadurch gekennzeichnet, dass sie mit inaktiven Lösungen von sauerstoffhaltigen Metallen erfolgt. Diese Lösungen, zu denen Verbindungen wie Nitrate und Sulfate gehören, sind besonders wichtig für industrielle Anwendungen, bei denen die Erzeugung von Sauerstoff ein kritischer Prozess ist.
Bei dieser Art der Elektrolyse spielen die inaktiven Metalle, die nicht ohne Weiteres an chemischen Reaktionen teilnehmen, eine entscheidende Rolle. Die Oxygenate in der Lösung dienen als primäre Sauerstoffquelle und erleichtern den elektrolytischen Prozess. Die Stabilität dieser inaktiven Metalle sorgt dafür, dass die Elektrolysezelle effizient arbeiten kann, ohne dass das Risiko einer Verunreinigung oder unbeabsichtigter Reaktionen besteht.
Der Prozess beinhaltet die Zersetzung der Sauerstoffverbindungen, was zur Freisetzung von Sauerstoffgas an der Anode führt. Diese Freisetzung ist eine direkte Folge der elektrolytischen Wirkung, bei der der angelegte elektrische Strom die Oxygenate in ihre Bestandteile zerlegt. Die inaktiven Metalle bleiben weitgehend unbeeinflusst, so dass die Integrität und Reinheit der elektrolytischen Umgebung erhalten bleibt.
Zu den wichtigsten Faktoren, die bei dieser Art der Elektrolyse zu berücksichtigen sind, gehören die Konzentration der sauerstoffhaltigen Verbindungen in der Lösung und die Stabilität der inaktiven Metalle. Die Konzentration sollte sorgfältig kontrolliert werden, um eine optimale Sauerstofferzeugung zu gewährleisten, während die Metalle aufgrund ihrer Inertheit ausgewählt werden müssen, um eine Beeinträchtigung des elektrolytischen Prozesses zu verhindern.
Insgesamt muss die sauerstofferzeugende Säuretyp der Elektrolyse in Industriezweigen unverzichtbar, in denen eine genaue Kontrolle der Sauerstofferzeugung erforderlich ist, wie z. B. bei der Metallraffination und bestimmten chemischen Herstellungsverfahren.
Energieumwandlung und Elektrolysebedingungen
Merkmale von Kathode und Anode
Bei elektrolytischen Verfahren können die Aufgaben von Kathode und Anode je nach der in der Zelle ablaufenden spezifischen Reaktion erheblich variieren. Obwohl diese Elektroden grundlegende Bestandteile der Elektrolysezelle sind, ist ihre Beteiligung an der chemischen Reaktion nicht immer eindeutig.
Die Kathode, in der Regel der Ort der Reduktion, und die Anode, an der die Oxidation stattfindet, sind nicht unbedingt direkt an der Reaktion beteiligt. Das bedeutet, dass die Elektroden selbst während des gesamten Prozesses chemisch inert bleiben können und lediglich als Kanäle für den Elektronenfluss dienen. In einigen Elektrolysezellen bestehen die Elektroden beispielsweise aus Materialien wie Platin oder Graphit, die für ihre chemische Stabilität und Reaktionsbeständigkeit unter den Bedingungen der Elektrolyse bekannt sind.
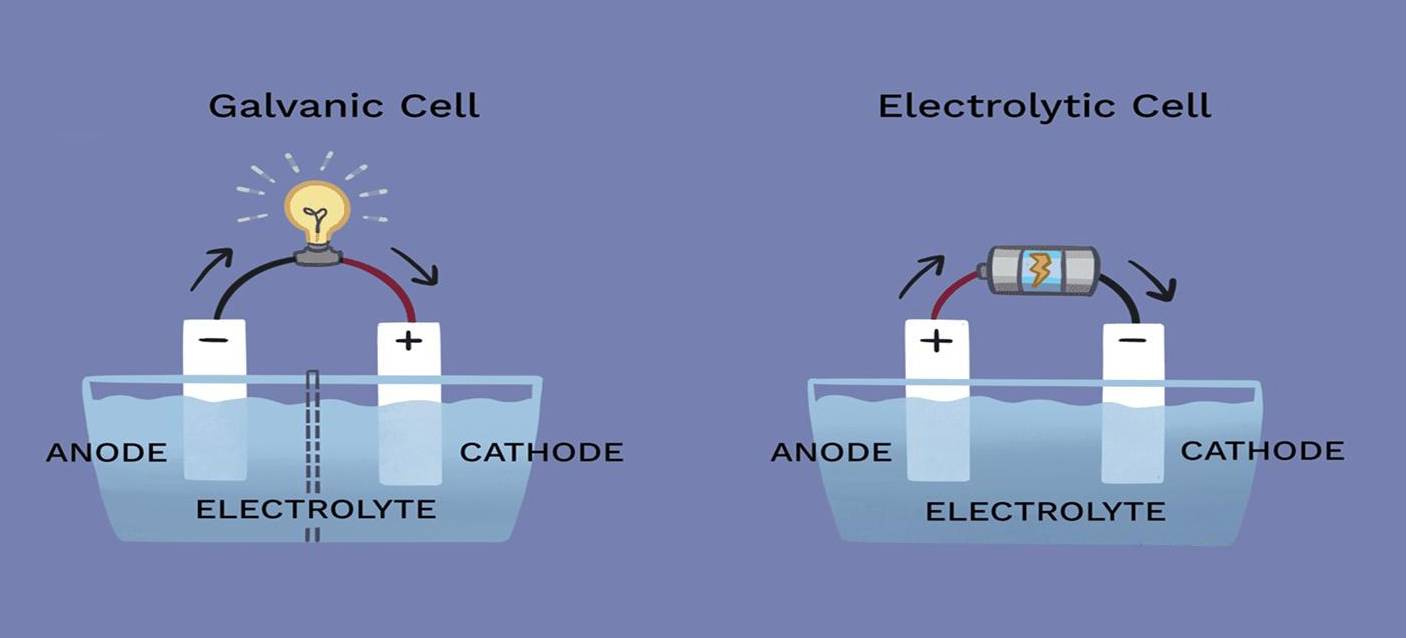
Außerdem ist die Forderung nach Inertheit nicht universell. In bestimmten Anwendungen werden aktive Elektroden eingesetzt, die sich während des Prozesses verändern können. Diese aktiven Elektroden können die Reaktionsdynamik beeinflussen und möglicherweise die Effizienz oder das Ergebnis der Elektrolyse verändern. Daher ist die Wahl zwischen inerten und aktiven Elektroden eine entscheidende konstruktive Überlegung, die sich auf die Gesamtleistung und Effektivität der Elektrolysezelle auswirkt.
Bedingungen für die Elektrolyse
Die Elektrolyse ist ein Prozess, der bestimmte Bedingungen erfordert, um effektiv zu funktionieren. Im Kern erfordert die Elektrolyse eine Gleichstrom (DC) als Energiequelle . Dadurch wird ein gleichmäßiger Stromfluss gewährleistet, der für die chemischen Reaktionen an den Elektroden unerlässlich ist.
Der Aufbau umfasst verschiedene Anschlüsse für die Kathode und Anode . Die Kathode, die Kationen anzieht, wird in der Regel an den negativen Anschluss der Gleichstromversorgung angeschlossen, während die Anode, die Anionen anzieht, an den positiven Anschluss angeschlossen wird. Diese Verbindungen sind entscheidend für die richtige Richtung des Elektronenflusses und die nachfolgenden chemischen Umwandlungen.
Damit die Elektrolyse stattfinden kann, müssen die Elektroden in eine Elektrolytlösung oder einem geschmolzenen Elektrolyt . Der Elektrolyt dient als Medium, durch das sich die Ionen bewegen können und das die Leitung von Elektrizität erleichtert. Die Wahl des Elektrolyten ist von entscheidender Bedeutung, da er in der Lage sein muss, in Ionen zu dissoziieren, die an den elektrochemischen Reaktionen teilnehmen können.
Schließlich muss ein geschlossener Kreislauf notwendig, um den elektrischen Weg zu vervollständigen. Dadurch wird sichergestellt, dass die Elektronen durch den externen Stromkreis von der Anode zur Kathode fließen können, während sich die Ionen durch die Elektrolytlösung bewegen. Ohne einen geschlossenen Kreislauf würde der Stromfluss unterbrochen werden und der Elektrolyseprozess würde aufhören.
Ähnliche Produkte
- Flache Korrosions-Elektrolysezelle
- Elektrochemische Elektrolysezelle mit fünf Anschlüssen
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
- Doppelschichtige Fünfloch-Wasserbad-Elektrolysezelle
- Multifunktionale Elektrolysezellen-Wasserbäder, einlagig, doppelwandig
Ähnliche Artikel
- Fortschrittliche Elektrolysezellentechniken für modernste Laborforschung
- Anwendungen der H-Typ-Elektrolysezelle in der Metallextraktion
- Erforschung des multifunktionalen Elektrolysezellen-Wasserbads: Anwendungen und Vorteile
- Fortgeschrittene Techniken zur Bewertung von Beschichtungen mit elektrolytischen Zellen
- Elektroabscheidung mit elektrochemischen Elektroden verstehen














