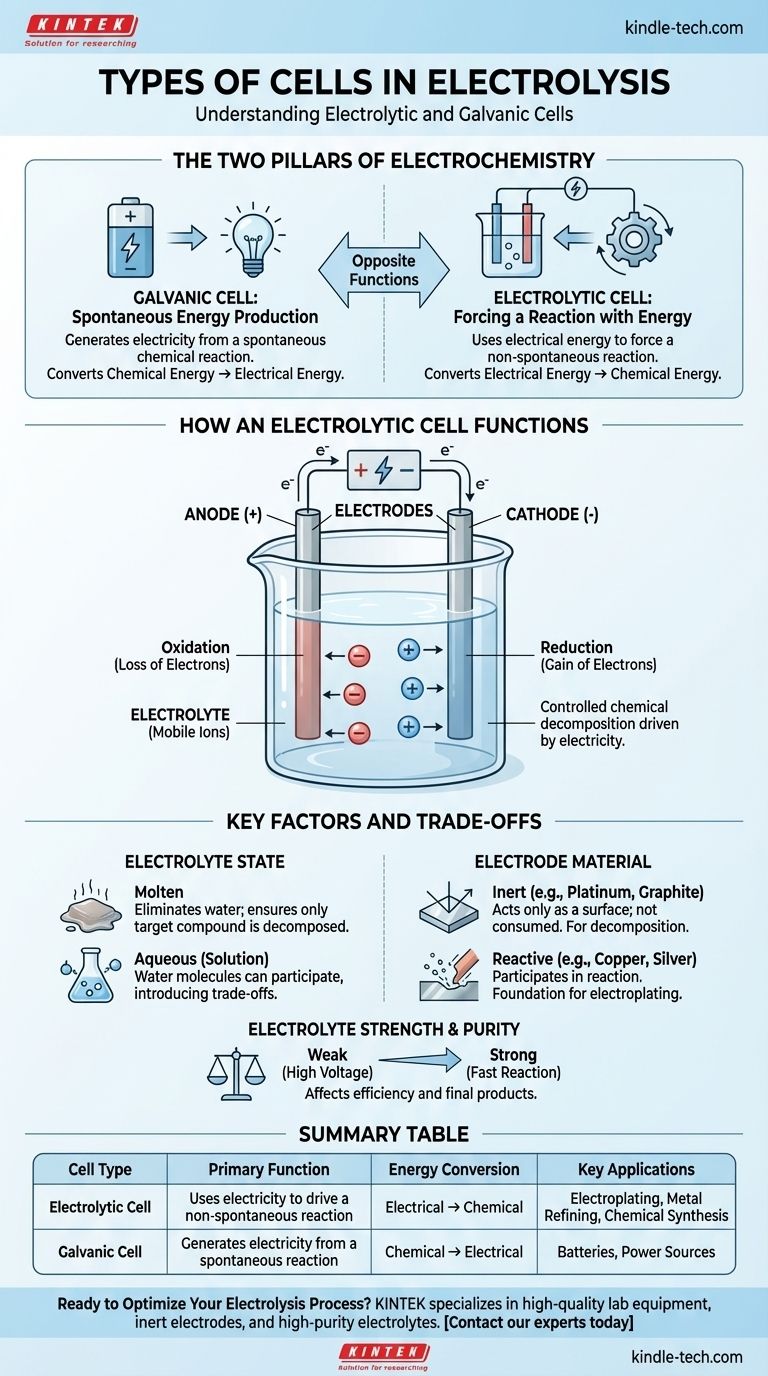
Im Kern findet die Elektrolyse innerhalb einer bestimmten Art von elektrochemischer Zelle statt, die als elektrolytische Zelle bekannt ist. Diese Zelle ist einer von zwei grundlegenden Typen elektrochemischer Zellen, der andere ist die galvanische Zelle. Eine elektrolytische Zelle nutzt elektrische Energie, um eine nicht-spontane chemische Reaktion zu erzwingen, während eine galvanische Zelle das Gegenteil tut und Elektrizität aus einer spontanen chemischen Reaktion erzeugt.
Der entscheidende Unterschied liegt im Zweck. Eine galvanische Zelle (wie eine Batterie) erzeugt Elektrizität aus einer chemischen Reaktion. Eine elektrolytische Zelle nutzt Elektrizität, um eine chemische Reaktion anzutreiben, die von selbst nicht ablaufen würde.

Die zwei Säulen der Elektrochemie
Um die Zelle für die Elektrolyse zu verstehen, müssen Sie zuerst ihr Gegenstück kennenlernen. Beide Zelltypen sind grundlegend für die Elektrochemie, dienen aber entgegengesetzten Funktionen.
Die galvanische Zelle: Spontane Energieerzeugung
Eine galvanische Zelle ist das, was wir allgemein als Batterie kennen. Sie nutzt eine spontane chemische Reaktion, die von Natur aus ablaufen möchte.
Wenn diese Reaktion fortschreitet, setzt sie Energie in Form eines elektrischen Stroms frei. Sie wandelt gespeicherte chemische Energie direkt in elektrische Energie um.
Die elektrolytische Zelle: Erzwingen einer Reaktion mit Energie
Eine elektrolytische Zelle ist der Motor der Elektrolyse. Sie ist darauf ausgelegt, eine nicht-spontane chemische Reaktion durch Zufuhr externer Energie zu bewirken.
Sie legen einen elektrischen Strom aus einer externen Quelle (wie einem Netzteil) an die Zelle an. Dies erzwingt die Zersetzung einer Substanz und wandelt effektiv elektrische Energie zurück in chemische Energie um, indem neue Substanzen gebildet werden.
Funktionsweise einer elektrolytischen Zelle
Der Prozess der Elektrolyse ist eine durch Elektrizität gesteuerte chemische Zersetzung. Dies erfordert einige Schlüsselkomponenten, die zusammenarbeiten.
Die Kernkomponenten
Eine elektrolytische Zelle besteht aus zwei Elektroden (einer positiven Anode und einer negativen Kathode), die in einen Elektrolyten eingetaucht sind. Eine externe Stromquelle ist mit diesen Elektroden verbunden, wodurch ein Stromkreis entsteht.
Die Rolle des Elektrolyten
Der Elektrolyt ist die Substanz, die zersetzt werden soll. Es handelt sich typischerweise um eine ionische Verbindung, entweder im geschmolzenen Zustand oder in einer Lösung gelöst (wässrig).
Diese Substanz muss bewegliche Ionen enthalten, die frei sind, sich zu bewegen und eine Ladung zu transportieren. Elektrolyte sind im Allgemeinen Lösungen von Säuren, Basen oder Salzen.
Die Funktion der Elektroden
Die Elektroden sind die Leiter, durch die der Strom in den Elektrolyten ein- und austritt.
- Anode: Die positive Elektrode. Sie zieht negative Ionen (Anionen) an, wo die Oxidation (Elektronenabgabe) stattfindet.
- Kathode: Die negative Elektrode. Sie zieht positive Ionen (Kationen) an, wo die Reduktion (Elektronenaufnahme) stattfindet.
Die externe Stromquelle ist das, was diese Ladungstrennung aufrechterhält und den gesamten Prozess antreibt.
Verständnis der Schlüsselfaktoren und Kompromisse
Das Ergebnis der Elektrolyse ist nicht automatisch. Die spezifischen Produkte, die Sie erzeugen, hängen vollständig von den gewählten Materialien und Bedingungen ab.
Zustand des Elektrolyten: Geschmolzen vs. Wässrig
Der Zustand des Elektrolyten ist eine kritische Entscheidung. Wenn Sie eine wässrige Lösung (in Wasser gelöst) verwenden, können die Wassermoleküle selbst an der Reaktion teilnehmen.
Dies führt zu einem Kompromiss, da die Elektrizität je nachdem, welche Reaktion leichter zu erzwingen ist, das Wasser anstelle der gelösten Verbindung spaltet. Die Verwendung eines geschmolzenen Elektrolyten eliminiert Wasser aus der Gleichung und stellt sicher, dass nur die Zielverbindung zersetzt wird.
Elektrodenmaterial: Inert vs. Reaktiv
Elektroden können passive Teilnehmer oder aktive Akteure in der Reaktion sein.
- Inerte Elektroden (z. B. Platin, Graphit): Diese dienen nur als Oberfläche, auf der die Reaktion stattfindet. Sie werden nicht verbraucht und werden verwendet, wenn Sie den Elektrolyten selbst zersetzen möchten, wie z. B. die Spaltung von Wasser in Wasserstoff und Sauerstoff.
- Reaktive Elektroden (z. B. Kupfer, Silber): Diese können sich auflösen oder an der chemischen Reaktion teilnehmen. Dies ist das Prinzip hinter der Galvanik (Electroplating), bei dem sich die Anode auflöst und ihre Metallionen auf dem Objekt an der Kathode abgeschieden werden.
Elektrolytstärke und Reinheit
Die Effizienz der Elektrolyse wird auch durch den Elektrolyten beeinflusst. Starke Elektrolyte, die sich vollständig in Ionen dissoziieren, leiten Elektrizität gut und ermöglichen eine schnellere Reaktion.
Schwache Elektrolyte benötigen mehr Energie (eine höhere Spannung), um die Reaktion einzuleiten und aufrechtzuerhalten. Das Vorhandensein anderer Oxidations- oder Reduktionsmittel im Elektrolyten kann ebenfalls die Endprodukte verändern.
Anwendung auf Ihr Ziel
Das Verständnis der Funktion einer elektrolytischen Zelle ermöglicht es Ihnen, chemische Reaktionen für spezifische industrielle und wissenschaftliche Zwecke zu steuern.
- Wenn Ihr Hauptaugenmerk auf der Herstellung einer reinen Substanz liegt: Wählen Sie eine inerte Elektrode und einen hochreinen Elektrolyten (geschmolzen oder wässrig), um sicherzustellen, dass Sie die Zielverbindung zersetzen, wie z. B. bei der Gewinnung von Aluminium aus Bauxit.
- Wenn Ihr Hauptaugenmerk auf der Beschichtung oder Reinigung eines Metalls liegt: Verwenden Sie eine reaktive Anode aus dem Beschichtungsmaterial und einen Elektrolyten, der Ionen desselben Metalls enthält. Dies ist die Grundlage der Galvanik und der Elektroraffination.
- Wenn Ihr Hauptaugenmerk auf der Stromerzeugung liegt: Sie benötigen eine galvanische Zelle, keine elektrolytische, da deren Funktion darin besteht, Energie aus einer spontanen Reaktion freizusetzen.
Letztendlich bietet die Elektrolyse eine leistungsstarke Methode, um elektrische Energie zur präzisen Steuerung und Durchführung chemischer Veränderungen zu nutzen.
Zusammenfassungstabelle:
| Zelltyp | Hauptfunktion | Energieumwandlung | Wichtige Anwendungen |
|---|---|---|---|
| Elektrolytische Zelle | Verwendet Elektrizität, um eine nicht-spontane Reaktion anzutreiben | Elektrisch → Chemisch | Galvanik, Metallraffination, Chemische Synthese |
| Galvanische Zelle | Erzeugt Elektrizität aus einer spontanen Reaktion | Chemisch → Elektrisch | Batterien, Energiequellen |
Bereit, Ihren Elektrolyseprozess zu optimieren?
Das Verständnis des richtigen Zelltyps und der Komponenten ist entscheidend für eine effiziente Galvanik, Metallraffination oder chemische Synthese. KINTEK ist spezialisiert auf die Bereitstellung hochwertiger Laborgeräte und Verbrauchsmaterialien, einschließlich inerter Elektroden und hochreiner Elektrolyte, um sicherzustellen, dass Ihre elektrolytischen Prozesse präzise und effektiv sind.
Kontaktieren Sie noch heute unsere Experten, um Ihre spezifische Anwendung zu besprechen und herauszufinden, wie unsere Lösungen die Fähigkeiten und Ergebnisse Ihres Labors verbessern können.
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Elektrolysezelle mit fünf Anschlüssen
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
- PTFE Elektrolysezelle Elektrochemische Zelle Korrosionsbeständig Abgedichtet und Nicht Abgedichtet
Andere fragen auch
- Welche allgemeine Vorsichtsmaßnahme sollte beim Umgang mit der Elektrolysezelle getroffen werden? Sorgen Sie für sichere und genaue Laborergebnisse
- Wie können Lecks bei der Verwendung einer Fünf-Port-Wasserbad-Elektrolysezelle verhindert werden? Sorgen Sie für einen zuverlässigen und sicheren elektrochemischen Aufbau
- Aus welchem Material besteht die Fünf-Port-Elektrolysezelle mit Wasserbad? Hochborosilikatglas & PTFE erklärt
- Wie sollte der Körper einer Elektrolysezelle für eine lange Lebensdauer gewartet werden? Verlängern Sie die Lebensdauer Ihrer Ausrüstung
- Wie sind die richtigen Lagerungsverfahren für die multifunktionale Elektrolysezelle? Schützen Sie Ihre Investition und gewährleisten Sie die Datengenauigkeit



















