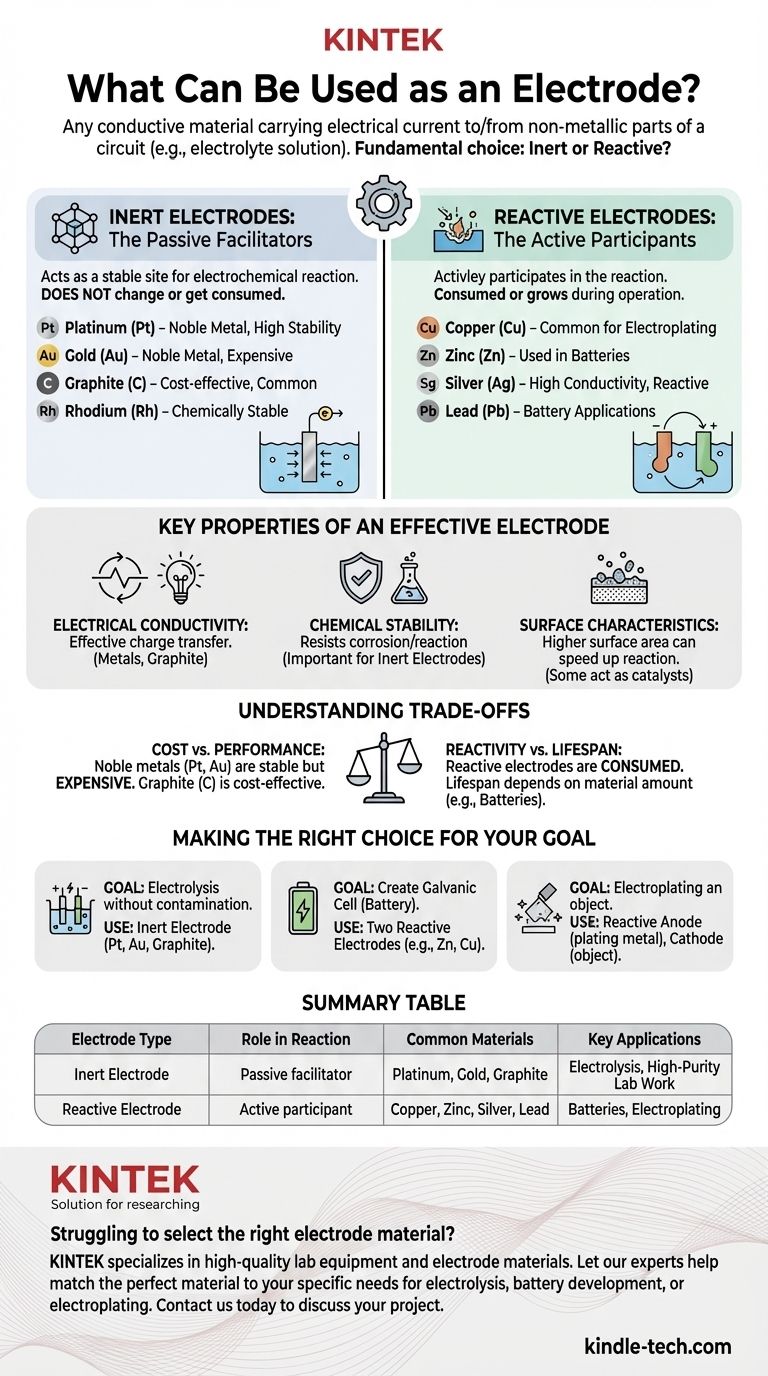
Kurz gesagt, eine Elektrode ist jedes leitfähige Material, das einen elektrischen Strom in einen nichtmetallischen Teil eines Stromkreises, wie z. B. eine Elektrolytlösung, hinein- oder herausführt. Elektroden werden grob in zwei Kategorien eingeteilt: inerte Elektroden, die sich nicht an der chemischen Reaktion beteiligen, und reaktive Elektroden, die dies tun. Gängige Beispiele sind Metalle wie Platin, Gold, Kupfer und Zink sowie Nichtmetalle wie Graphit (Kohlenstoff).
Die Wahl der Elektrode ist eine kritische Designentscheidung in jedem elektrochemischen System. Die grundlegende Wahl ist nicht nur „welches Material leitet Elektrizität“, sondern ob Sie ein Material benötigen, das unverändert bleibt (inert), oder eines, das aktiv an der chemischen Reaktion teilnimmt (reaktiv).

Die zwei grundlegenden Arten von Elektroden
Die wichtigste Unterscheidung bei der Auswahl eines Elektrodenmaterials ist seine Rolle in der beabsichtigten chemischen Reaktion. Dies teilt alle potenziellen Materialien in zwei Hauptgruppen ein.
Inerte Elektroden: Die passiven Wegbereiter
Eine inerte Elektrode dient als stabile, nicht reaktive Stelle, an der eine elektrochemische Reaktion stattfinden kann. Ihre Aufgabe ist es lediglich, Elektronen zum oder vom Elektrolyten zu leiten.
Das Material selbst verändert sich nicht, wird nicht verbraucht oder löst sich in der Lösung auf. Es ist lediglich eine Oberfläche.
Aus diesem Grund müssen inerte Elektroden aus Materialien bestehen, die in dem verwendeten Elektrolyten chemisch stabil sind. Gängige Optionen sind Edelmetalle und Kohlenstoff.
Beispiele für inerte Elektroden:
- Platin (Pt)
- Gold (Au)
- Graphit (C)
- Rhodium (Rh)
Reaktive Elektroden: Die aktiven Teilnehmer
Eine reaktive Elektrode ist ein aktiver Teilnehmer an der elektrochemischen Reaktion. Sie wird entweder oxidiert (löst sich im Elektrolyten auf) oder ist das Produkt der Reduktion (plattiert sich auf der Oberfläche ab).
Diese Materialien werden gezielt wegen ihrer Fähigkeit ausgewählt, auf kontrollierte Weise zu reagieren. Dies ist das Prinzip hinter Batterien und Galvanik.
Die Elektrode selbst wird während des Betriebs der elektrochemischen Zelle verbraucht oder wächst.
Beispiele für reaktive Elektroden:
- Kupfer (Cu)
- Zink (Zn)
- Silber (Ag)
- Blei (Pb)
Schlüsseleigenschaften einer effektiven Elektrode
Über die grundlegende Klassifizierung hinaus bestimmen mehrere Eigenschaften, wie gut ein Material für einen bestimmten Zweck als Elektrode fungiert.
Elektrische Leitfähigkeit
Dies ist die grundlegendste Anforderung. Das Material muss ein effektiver Leiter der Elektrizität sein, um Ladung zwischen dem externen Stromkreis und dem Elektrolyten zu übertragen. Metalle und Graphit sind aus diesem Grund ausgezeichnete Optionen.
Chemische Stabilität
Damit eine Elektrode als inert gilt, muss sie Korrosion oder Reaktion mit dem Elektrolyten und allen während der Reaktion entstehenden Substanzen widerstehen. Deshalb sind Edelmetalle wie Platin und Gold für diese Anwendungen hoch geschätzt.
Oberflächeneigenschaften
Die Reaktion findet auf der Oberfläche der Elektrode statt. Ein Material mit einer größeren Oberfläche kann oft eine schnellere Reaktionsgeschwindigkeit unterstützen. Darüber hinaus können einige Materialien, wie Platin, als Katalysatoren wirken und die für den Ablauf einer Reaktion erforderliche Energie senken.
Die Abwägungen verstehen
Die theoretisch „beste“ Elektrode ist nicht immer die praktischste. Anwendungen in der realen Welt erfordern eine Abwägung zwischen Leistung und anderen Faktoren.
Kosten vs. Leistung
Edelmetalle wie Platin und Gold sind aufgrund ihrer extremen Stabilität hervorragende inerte Elektroden, aber sie sind sehr teuer.
Für viele Anwendungen bietet Graphit eine weitaus kostengünstigere Alternative. Obwohl es möglicherweise weniger haltbar oder katalytisch aktiv als Platin ist, macht es sein geringer Preis zur dominierenden Wahl für unzählige industrielle Prozesse.
Reaktivität vs. Lebensdauer
Per Definition werden reaktive Elektroden im Laufe der Zeit verbraucht. Dies ist eine notwendige Funktion in Anwendungen wie galvanischen Zellen (Batterien), bei denen der Verbrauch der Elektrode den elektrischen Strom erzeugt.
Dies bedeutet, dass die Lebensdauer des Geräts direkt an die Menge des verfügbaren reaktiven Elektrodenmaterials gebunden ist. Die Wahl des Materials bestimmt die Spannung und die Lebensdauer der Zelle.
Die richtige Wahl für Ihr Ziel treffen
Ihre Wahl des Elektrodenmaterials sollte ausschließlich vom Ziel Ihrer elektrochemischen Zelle bestimmt werden.
- Wenn Ihr Hauptaugenmerk auf Elektrolyse ohne Kontamination liegt: Sie benötigen eine inerte Elektrode. Verwenden Sie Platin oder Gold für hochreine Laborarbeiten oder Graphit (Kohlenstoff) als kostengünstige Alternative.
- Wenn Ihr Hauptaugenmerk auf dem Aufbau einer galvanischen Zelle (einer Batterie) liegt: Sie benötigen zwei unterschiedliche reaktive Elektroden. Verwenden Sie Materialien wie Zink und Kupfer, deren Potenzialdifferenz den elektrischen Strom antreibt.
- Wenn Ihr Hauptaugenmerk auf der Galvanisierung eines Objekts liegt: Ihre Anode (positive Elektrode) sollte eine reaktive Elektrode aus dem zu plattierenden Metall sein (z. B. Silber), und Ihre Kathode (negative Elektrode) ist das Objekt selbst.
Letztendlich ist die richtige Elektrode diejenige, deren chemische und physikalische Eigenschaften genau auf die spezifische Funktion abgestimmt sind, die sie in Ihrer elektrochemischen Zelle erfüllen muss.
Zusammenfassungstabelle:
| Elektrodentyp | Rolle bei der Reaktion | Häufige Materialien | Wichtige Anwendungen |
|---|---|---|---|
| Inerte Elektrode | Passiver Wegbereiter; reagiert nicht | Platin, Gold, Graphit | Elektrolyse, hochreine Laborarbeiten |
| Reaktive Elektrode | Aktiver Teilnehmer; wird verbraucht oder gebildet | Kupfer, Zink, Silber, Blei | Batterien, Galvanik |
Haben Sie Schwierigkeiten bei der Auswahl des richtigen Elektrodenmaterials für Ihre Anwendung? Die Leistung Ihres elektrochemischen Prozesses hängt von dieser kritischen Wahl ab. KINTEK ist spezialisiert auf die Bereitstellung hochwertiger Laborgeräte und Verbrauchsmaterialien, einschließlich einer breiten Palette von Elektrodenmaterialien wie Platin, Graphit und reaktiven Metallen. Unsere Experten helfen Ihnen dabei, das perfekte Material für Ihre spezifischen Bedürfnisse zu finden – sei es für Elektrolyse, Batterieentwicklung oder Galvanik –, um optimale Ergebnisse und Effizienz zu gewährleisten. Kontaktieren Sie uns noch heute, um Ihr Projekt zu besprechen, und lassen Sie KINTEK Ihr Partner für Präzision sein. Kontaktieren Sie uns über unser Kontaktformular
Visuelle Anleitung
Ähnliche Produkte
- Platinblechelektrode für Labor- und Industrieanwendungen
- Rotierende Platindisk-Elektrode für elektrochemische Anwendungen
- Graphit-Scheiben-Stab- und Plattenelektrode Elektrochemische Graphitelektrode
- Platin-Hilfselektrode für Laboranwendungen
- Goldplattierte Elektrode
Andere fragen auch
- Was sind die Funktionen einer gesättigten Kalomelelektrode und einer Salzbrücke bei Experimenten zur Korrosionsinhibition in saurer Umgebung?
- Was ist die Funktion von platinbeschichteten Edelstahlelektroden? Verbesserung der katalytischen Stabilität & HER-Leistung
- Wie unterstützt ein leitfähiger Stab aus Edelstahl die Kathodenoperationen? Wichtige Tipps für den Erfolg der FFC-Elektrolyse
- Welche Rolle spielt Titandraht in SMFCs mit Meerwasser? Gewährleistung von Stabilität & Schutz des mikrobiellen Lebens
- Welche regelmäßige Wartung ist für eine Platindisktenelektrode erforderlich? Gewährleisten Sie jedes Mal genaue elektrochemische Daten
- Welche gängigen Formen und Größen haben Glaskohlenstoffelektroden? Wichtige Spezifikationen für reproduzierbare Ergebnisse
- Wie lautet das korrekte Nachbehandlungsverfahren für eine Platinelektrode? Bewahren Sie Ihre Elektrode für genaue Ergebnisse
- Was ist der Zweck von Ag/AgCl-Referenzelektroden für Zr2.5Nb-Legierungen? Präzision bei Korrosionsprüfungen gewährleisten