Grundsätzlich ist eine Elektrolysezelle ein Gerät, das elektrische Energie nutzt, um eine chemische Reaktion zu erzwingen, die von selbst nicht ablaufen würde. Sie kehrt effektiv den Prozess einer Batterie um, indem sie Energie verbraucht, um Verbindungen zu zersetzen oder neue zu synthetisieren. Dies wird erreicht, indem ein Gleichstrom durch eine Substanz, den Elektrolyten, geleitet wird, was erzwungene chemische Änderungen an zwei Elektroden bewirkt.
Eine Elektrolysezelle versteht sich am besten als ein System zur Umwandlung von elektrischer Energie in chemische Energie. Sie funktioniert, indem eine externe Spannung angelegt wird, um den natürlichen Zustand eines chemischen Systems zu überwinden und Ionen zur Reaktion und zur Bildung neuer Substanzen zu zwingen.

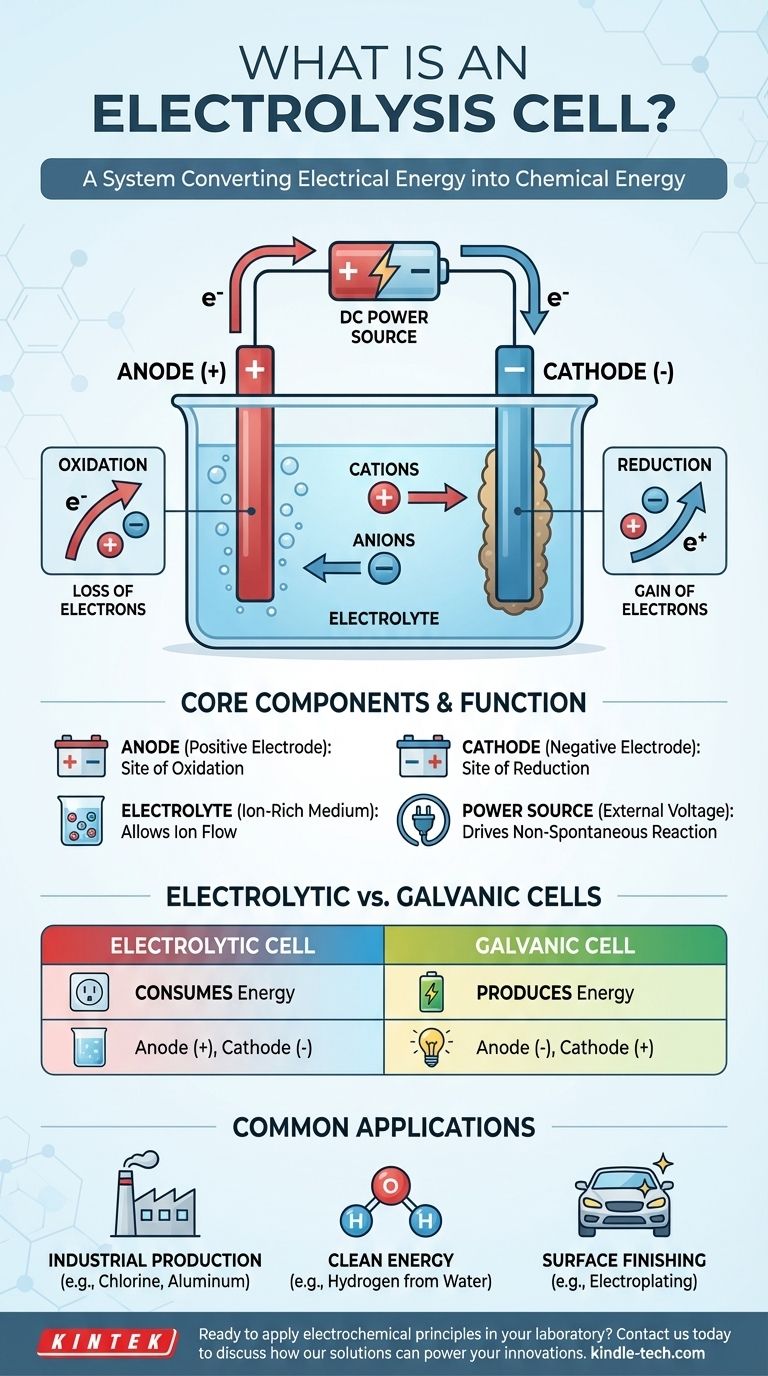
Wie eine Elektrolysezelle funktioniert
Um das Konzept zu verstehen, ist es wichtig, die drei Kernkomponenten und ihre Wechselwirkung bei der Einführung von Elektrizität zu kennen. Der Prozess ist ein kontrollierter und gerichteter Ladungsfluss, der zu chemischer Umwandlung führt.
Die drei wesentlichen Komponenten
Eine Elektrolysezelle besteht aus drei Hauptteilen:
- Eine Anode: Die Elektrode, die an den Pluspol der Stromquelle angeschlossen ist.
- Eine Kathode: Die Elektrode, die an den Minuspol der Stromquelle angeschlossen ist.
- Ein Elektrolyt: Eine Substanz, die frei bewegliche Ionen enthält, wie ein geschmolzenes Salz oder eine in einem Lösungsmittel wie Wasser gelöste ionische Verbindung.
Die Rolle der externen Spannung
Im Gegensatz zu einer Batterie (einer galvanischen Zelle), die spontan eine Spannung erzeugt, benötigt eine Elektrolysezelle eine externe Stromquelle. Diese angelegte Spannung erzeugt ein starkes elektrisches Feld und bestimmt die Polarität der Elektroden, wodurch die Anode positiv und die Kathode negativ wird.
Der Fluss von Ionen und Elektronen
Die angelegte Spannung zwingt die Ionen im Elektrolyten zur Wanderung. Positiv geladene Ionen (Kationen) werden zur negativen Kathode gezogen, während negativ geladene Ionen (Anionen) zur positiven Anode gezogen werden. Diese Wanderung bereitet die Bühne für die chemischen Reaktionen.
Oxidation und Reduktion: Die Kernchemie
Die eigentliche chemische Veränderung findet an der Oberfläche der Elektroden statt. Diese Reaktionen werden als „Redox“-Reaktionen bezeichnet, kurz für Reduktion und Oxidation.
Die Anode: Ort der Oxidation
Die Anode ist definiert als der Ort der Oxidation. Hier geben die zur positiven Elektrode gewanderten Anionen ihre überschüssigen Elektronen ab. Dieser Elektronenverlust ist die Definition der Oxidation.
Die Kathode: Ort der Reduktion
Die Kathode ist definiert als der Ort der Reduktion. Kationen, die zu dieser negativen Elektrode gezogen werden, nehmen Elektronen aus dem Stromkreis auf. Dieser Elektronenübergang ist die Definition der Reduktion, was oft zur Abscheidung eines neutralen Elements (wie eines Metalls) auf der Kathode führt.
Den Hauptunterschied verstehen: Elektrolytische vs. Galvanische Zellen
Ein häufiger Verwechslungspunkt ist der Unterschied zwischen einer Elektrolysezelle und einer galvanischen Zelle (wie einer normalen Batterie). Das Verständnis ihrer gegensätzlichen Funktionen ist entscheidend.
Energieverbrauch vs. Energieerzeugung
Der wichtigste Unterschied ist der Energiefluss. Eine Elektrolysezelle verbraucht Energie, um eine nicht-spontane Reaktion zu erzwingen. Eine galvanische Zelle setzt Energie aus einer spontanen Reaktion frei.
Elektrodenpolarität
Dieser Funktionsunterschied führt zu einer umgekehrten Vorzeichenkonvention für die Elektroden.
- In einer Elektrolysezelle ist die Anode positiv und die Kathode negativ.
- In einer galvanischen Zelle ist die Anode negativ und die Kathode positiv.
Denken Sie daran, dass in beiden Zelltypen die Oxidation immer an der Anode und die Reduktion immer an der Kathode stattfindet. Die Polarität ist das, was sich ändert.
Häufige Anwendungen der Elektrolyse
Die Fähigkeit, chemische Veränderungen durch Elektrizität zu erzwingen, macht Elektrolysezellen in vielen Industriezweigen äußerst nützlich.
Industrielle Produktion
Die Elektrolyse ist der Eckpfeiler der Chloralkali-Industrie, die Chlorgas und Natriumhydroxid produziert. Sie ist auch für die Gewinnung reiner Metalle wie Aluminium und Kupfer aus ihren Erzen unerlässlich.
Saubere Energie
Eine der vielversprechendsten Anwendungen ist die Wasserelektrolyse. Durch das Leiten eines Stroms durch Wasser kann dieses in seine Bestandteile Wasserstoff und Sauerstoff gespalten werden. Der entstehende Wasserstoff kann als sauberer Brennstoff verwendet werden.
Oberflächenveredelung
Die Galvanisierung (Electroplating) ist ein gängiges Verfahren, bei dem eine Elektrolysezelle verwendet wird, um eine dünne Schicht eines Metalls (wie Gold oder Chrom) auf die Oberfläche eines anderen Objekts aufzubringen, das als Kathode dient.
Die richtige Wahl für Ihr Ziel treffen
Das Verständnis des Prinzips der Elektrolyse ermöglicht es Ihnen, es für spezifische Ziele anzuwenden.
- Wenn Ihr Hauptaugenmerk auf der Materialproduktion liegt (z. B. Wasserstoff): Erkennen Sie, dass die Zelle ein Werkzeug ist, um stabile, energiearme Verbindungen (wie Wasser) in energiereiche, wertvolle Produkte (wie H₂-Gas) zu zerlegen.
- Wenn Ihr Hauptaugenmerk auf der Oberflächenbeschichtung (Galvanisierung) liegt: Verstehen Sie, dass Ihr Zielobjekt die Kathode sein muss, da hier positive Metallionen reduziert und als feste Schicht abgeschieden werden.
- Wenn Ihr Hauptaugenmerk auf der grundlegenden Elektrochemie liegt: Die wichtigste Erkenntnis ist, dass eine Elektrolysezelle externe Energie nutzt, um einen natürlichen chemischen Prozess umzukehren, was sie zu einem leistungsstarken Motor für die Synthese macht.
Durch die Beherrschung dieser Prinzipien können Sie die Elektrolyse als ein leistungsstarkes und präzises Werkzeug für chemische Transformationen nutzen.
Zusammenfassungstabelle:
| Komponente | Funktion | Schlüsselmerkmal |
|---|---|---|
| Anode | Ort der Oxidation (Elektronenabgabe) | An den Pluspol der Stromquelle angeschlossen |
| Kathode | Ort der Reduktion (Elektronenaufnahme) | An den Minuspol der Stromquelle angeschlossen |
| Elektrolyt | Bietet Medium für den Ionenfluss | Ein geschmolzenes Salz oder eine ionische Lösung, die frei bewegliche Ionen enthält |
| Stromquelle | Erzwingt die nicht-spontane Reaktion | Liefert die für die Elektrolyse erforderliche externe Spannung |
Bereit, elektrochemische Prinzipien in Ihrem Labor anzuwenden?
Ob Ihr Projekt Materialsynthese, Galvanisierung oder die Entwicklung sauberer Energielösungen umfasst, die richtige Ausrüstung ist grundlegend. KINTEK ist spezialisiert auf die Bereitstellung hochwertiger Laborgeräte und Verbrauchsmaterialien zur Unterstützung Ihrer elektrochemischen Forschung und Entwicklung.
Kontaktieren Sie uns noch heute, um zu besprechen, wie unsere Lösungen Ihre Innovationen vorantreiben und die Präzision und Zuverlässigkeit bieten können, die Ihr Labor benötigt.
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Elektrolysezelle mit fünf Anschlüssen
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
Andere fragen auch
- Wie sind die richtigen Lagerungsverfahren für die multifunktionale Elektrolysezelle? Schützen Sie Ihre Investition und gewährleisten Sie die Datengenauigkeit
- Wie wird eine Elektrolysezelle mit fünf Anschlüssen im Wasserbad richtig gehandhabt? Gewährleistung genauer und sicherer elektrochemischer Experimente
- Wie können Lecks bei der Verwendung einer Fünf-Port-Wasserbad-Elektrolysezelle verhindert werden? Sorgen Sie für einen zuverlässigen und sicheren elektrochemischen Aufbau
- Wie sollte die Fünf-Port-Wasserbad-Elektrolysezelle zur Wartung gereinigt werden? Eine Schritt-für-Schritt-Anleitung für zuverlässige Ergebnisse
- Wie sollte der Körper einer Elektrolysezelle für eine lange Lebensdauer gewartet werden? Verlängern Sie die Lebensdauer Ihrer Ausrüstung



















