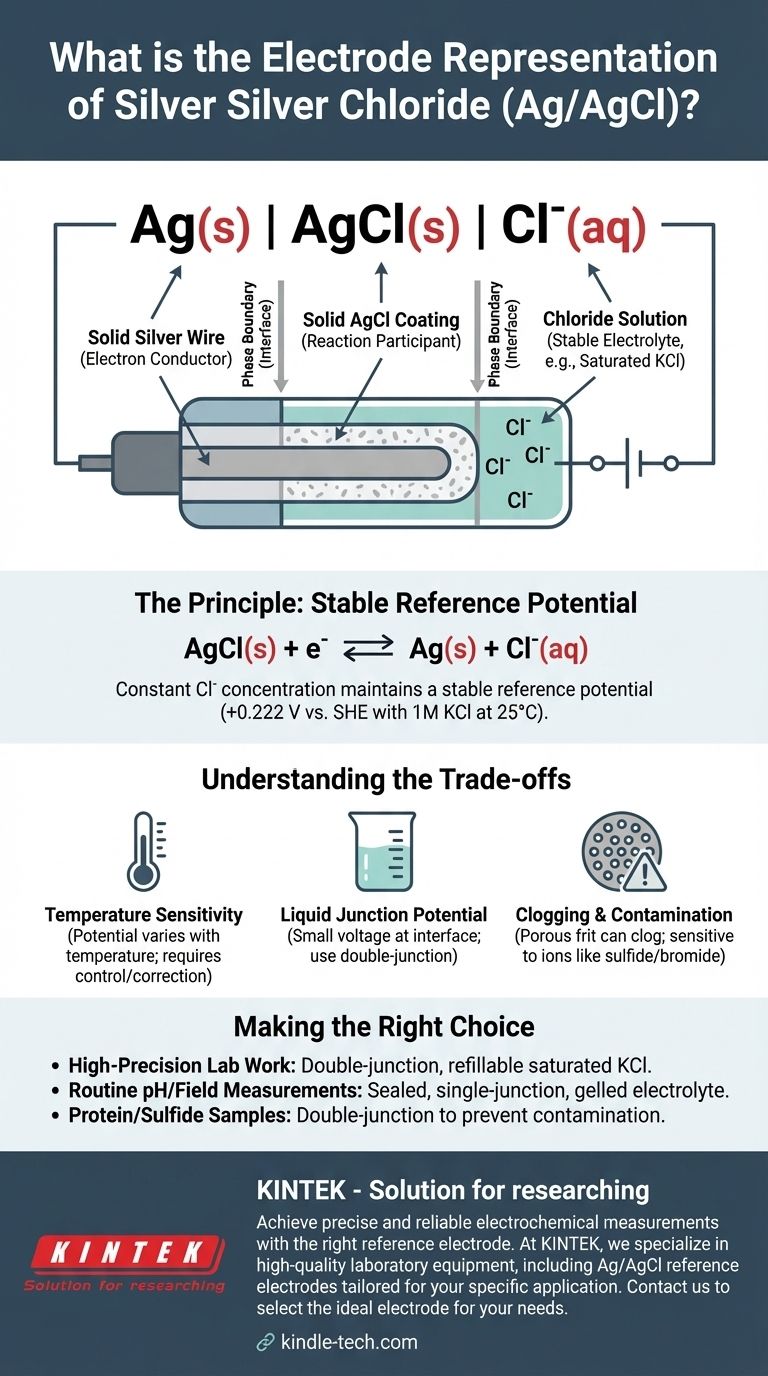
Die Standard-Kurzschreibweise für eine Silber-Silberchlorid-Elektrode ist Ag(s) | AgCl(s) | Cl⁻(aq). Diese elektrochemische Notation beschreibt die physikalischen und chemischen Phasen der Elektrode, vom festen Silberdraht bis zur wässrigen Lösung, die Chloridionen enthält. Das spezifische Potenzial der Elektrode hängt entscheidend von der Konzentration dieser Chloridionen ab.
Diese Notation ist mehr als eine technische Bezeichnung; sie ist ein Schema für eine der zuverlässigsten und gebräuchlichsten Referenzelektroden in der Elektrochemie. Sie beschreibt ein System, das darauf ausgelegt ist, ein konstantes, stabiles Potenzial aufrechtzuerhalten und eine feste Basislinie zu liefern, anhand derer die Potenziale anderer Elektroden genau gemessen werden können.

Dekonstruktion der Elektrodendarstellung
Die Darstellung Ag(s) | AgCl(s) | Cl⁻(aq) beschreibt die Struktur der Elektrode von innen nach außen. Jede Komponente und jedes Symbol hat eine präzise Bedeutung.
Die feste Phase: Ag(s)
Dies stellt einen festen Silberdraht dar. Dieser Draht dient als Elektronenleiter, der die Elektrode mit dem externen Messkreis (einem Voltmeter oder Potentiostaten) verbindet.
Die Phasengrenze: |
Der einzelne vertikale Strich | kennzeichnet eine Phasengrenze. Er zeigt die Grenzfläche an, an der zwei verschiedene physikalische Zustände aufeinandertreffen, in diesem Fall das feste Silbermetall und die feste Silberchloridschicht.
Die unlösliche Salzschicht: AgCl(s)
Dies bezeichnet eine Schicht aus festem, schwer löslichem Silberchlorid, die direkt auf die Oberfläche des Silberdrahtes aufgetragen ist. Diese Schicht ist das Herzstück der Elektrodenfunktion und nimmt direkt an der elektrochemischen Reaktion teil.
Die zweite Phasengrenze: |
Ein zweiter vertikaler Strich markiert die Grenze zwischen der festen Silberchloridbeschichtung und der umgebenden wässrigen Elektrolytlösung.
Die Elektrolytlösung: Cl⁻(aq)
Dies stellt die wässrige Lösung dar, in die der beschichtete Draht eingetaucht ist. Diese Lösung muss eine bekannte und konstante Konzentration von Chloridionen (Cl⁻) enthalten. Typischerweise wird eine Kaliumchlorid (KCl)-Lösung verwendet, oft in einer spezifischen Konzentration wie 1 M oder, am häufigsten, eine gesättigte Lösung.
Das Prinzip einer Referenzelektrode
Die Ag/AgCl-Elektrode wird nicht wegen ihrer eigenen Reaktion geschätzt, sondern wegen ihrer Stabilität. Sie liefert eine konstante Spannung, die als zuverlässiger Nullpunkt für andere Messungen dient.
Die maßgebliche Reaktion
Das stabile Potenzial wird durch ein reversibles Gleichgewicht zwischen den festen Komponenten und den Chloridionen in der Lösung hergestellt. Die Halbreaktion lautet:
AgCl(s) + e⁻ ⇌ Ag(s) + Cl⁻(aq)
Solange die Konzentration (genauer gesagt, die Aktivität) der Chloridionen in der Lösung konstant bleibt, ändert sich das Potenzial dieser Halbzelle nicht.
Die Bedeutung einer konstanten Chloridkonzentration
Die Verwendung einer gesättigten KCl-Lösung gewährleistet, dass die Cl⁻-Konzentration konstant und reproduzierbar ist. Wenn etwas Wasser verdunstet, löst sich einfach mehr KCl-Salz, um die Sättigung aufrechtzuerhalten. Deshalb ist das Referenzpotenzial so stabil. Für eine 1M KCl-Lösung bei 25°C (298 K) beträgt dieses Potenzial +0,222 V relativ zur Standard-Wasserstoffelektrode (SHE).
Die Kompromisse verstehen
Obwohl die Ag/AgCl-Elektrode sehr zuverlässig ist, hat sie auch Einschränkungen, die bei präzisen Arbeiten berücksichtigt werden müssen.
Temperaturempfindlichkeit
Das Potenzial der Elektrode ist eine Funktion der Temperatur. Für hochgenaue Messungen muss die Temperatur der Zelle kontrolliert oder die gemessenen Potenziale auf Temperaturschwankungen korrigiert werden.
Flüssigkeitsübergangspotenzial
Wenn die KCl-Lösung der Elektrode mit einer anderen Probenlösung in Kontakt kommt, kann an der Grenzfläche eine kleine Spannung, bekannt als Flüssigkeitsübergangspotenzial, entstehen. Dies führt zu einem kleinen, aber systematischen Fehler in der Messung, der durch die Verwendung einer Doppelsalzbrückenelektrode minimiert werden kann.
Verstopfung und Kontamination
Die poröse Fritte, die den elektrischen Kontakt zwischen der internen Lösung und der Probe ermöglicht, kann verstopfen. Sie kann auch durch Ionen in der Probe (wie Sulfid, Bromid oder Iodid) kontaminiert werden, die mit dem Silber reagieren können, wodurch das Elektrodenpotenzial im Laufe der Zeit abdriftet.
Die richtige Wahl für Ihre Messung treffen
Ihre Anwendung bestimmt, welche Elektrodenkonfiguration am besten geeignet ist.
- Wenn Ihr Hauptaugenmerk auf hochpräzisen Laborarbeiten liegt: Verwenden Sie eine Ag/AgCl-Doppelsalzbrückenelektrode mit einer nachfüllbaren, gesättigten KCl-Lösung, um das Übergangspotenzial zu minimieren und eine einfache Wartung zu ermöglichen.
- Wenn Ihr Hauptaugenmerk auf routinemäßigen pH- oder Feldmessungen liegt: Eine versiegelte Einzelsalzbrückenelektrode mit geliertem Elektrolyt ist langlebig, wartungsarm und völlig ausreichend.
- Wenn Ihr Hauptaugenmerk auf der Analyse von protein- oder sulfidhaltigen Proben liegt: Sie müssen eine Doppelsalzbrückenelektrode verwenden, um Verstopfungen und Kontaminationen der primären Referenzverbindung zu verhindern.
Das Verständnis dieser Notation verwandelt sie von einer kryptischen Bezeichnung in ein funktionales Schema für zuverlässige elektrochemische Messungen.
Zusammenfassungstabelle:
| Komponente | Symbol | Beschreibung |
|---|---|---|
| Fester Silberdraht | Ag(s) | Leiter, der mit dem externen Stromkreis verbunden ist. |
| Silberchloridbeschichtung | AgCl(s) | Unlösliche Salzschicht, die die reversible Reaktion ermöglicht. |
| Chloridionenlösung | Cl⁻(aq) | Wässriger Elektrolyt (z. B. KCl) mit konstanter Cl⁻-Konzentration. |
| Phasengrenze |
Erzielen Sie präzise und zuverlässige elektrochemische Messungen mit der richtigen Referenzelektrode.
Bei KINTEK sind wir auf hochwertige Laborgeräte spezialisiert, einschließlich einer Reihe von Ag/AgCl-Referenzelektroden, die auf Ihre spezifische Anwendung zugeschnitten sind – egal ob Sie hochpräzise Doppelsalzbrückenmodelle für empfindliche Laborarbeiten oder langlebige, wartungsarme Optionen für die Routineanalyse benötigen.
Unsere Experten helfen Ihnen gerne bei der Auswahl der idealen Elektrode, um ein stabiles Potenzial zu gewährleisten, Fehler zu minimieren und die Genauigkeit Ihrer Forschung zu verbessern.
Kontaktieren Sie KINTEK noch heute, um Ihre Laboranforderungen zu besprechen und herauszufinden, wie unsere zuverlässigen Verbrauchsmaterialien und Geräte Ihre Arbeit unterstützen können.
Visuelle Anleitung
Ähnliche Produkte
- Referenzelektrode Kalomel Silberchlorid Quecksilbersulfat für Laborzwecke
- Metall-Scheibenelektrode Elektrochemische Elektrode
- Rotierende Platindisk-Elektrode für elektrochemische Anwendungen
- Goldplattierte Elektrode
- RRDE-Rotations-Scheiben (Ring-Scheiben)-Elektrode / Kompatibel mit PINE, japanischem ALS, Schweizer Metrohm Glaskohlenstoff-Platin
Andere fragen auch
- Was sind die Vorteile eines Drei-Elektroden-Systems für Nickellegierungsfilme? Entsperren Sie hochpräzise Potenzialkontrolle
- Warum wird KCl in einer Kalomelelektrode verwendet? Für stabile Spannung & genaue Messungen
- Wie sollten eine Metallscheibenelektrode und der entsprechende Elektrolyt vor einem Experiment vorbereitet werden? Eine Schritt-für-Schritt-Anleitung
- Wie hoch ist die Reinheit der Gold- und Platinebleche, die für Experimente verwendet werden? Sicherstellung einer Reinheit von 99,99 % für zuverlässige Ergebnisse
- Welche Rollen spielen Platin- und Ag/AgCl-Elektroden bei der Beschichtungsanalyse? Gewährleistung von Präzision bei Tests
- Was ist zu tun, wenn eine Platindrahtelektrode schlechten Stromfluss aufweist? Ein Schritt-für-Schritt-Leitfaden zur Fehlerbehebung
- Was sind die Spezifikationen der Bleidioxid-Titan-Sauerstoffentwicklungselektrode? Erschließen Sie Hochleistungs-Oxidation
- Welche Vorbehandlungsschritte sollten vor der Verwendung eines Elektrodenhalters durchgeführt werden? Sorgen Sie für zuverlässige elektrochemische Messungen



















