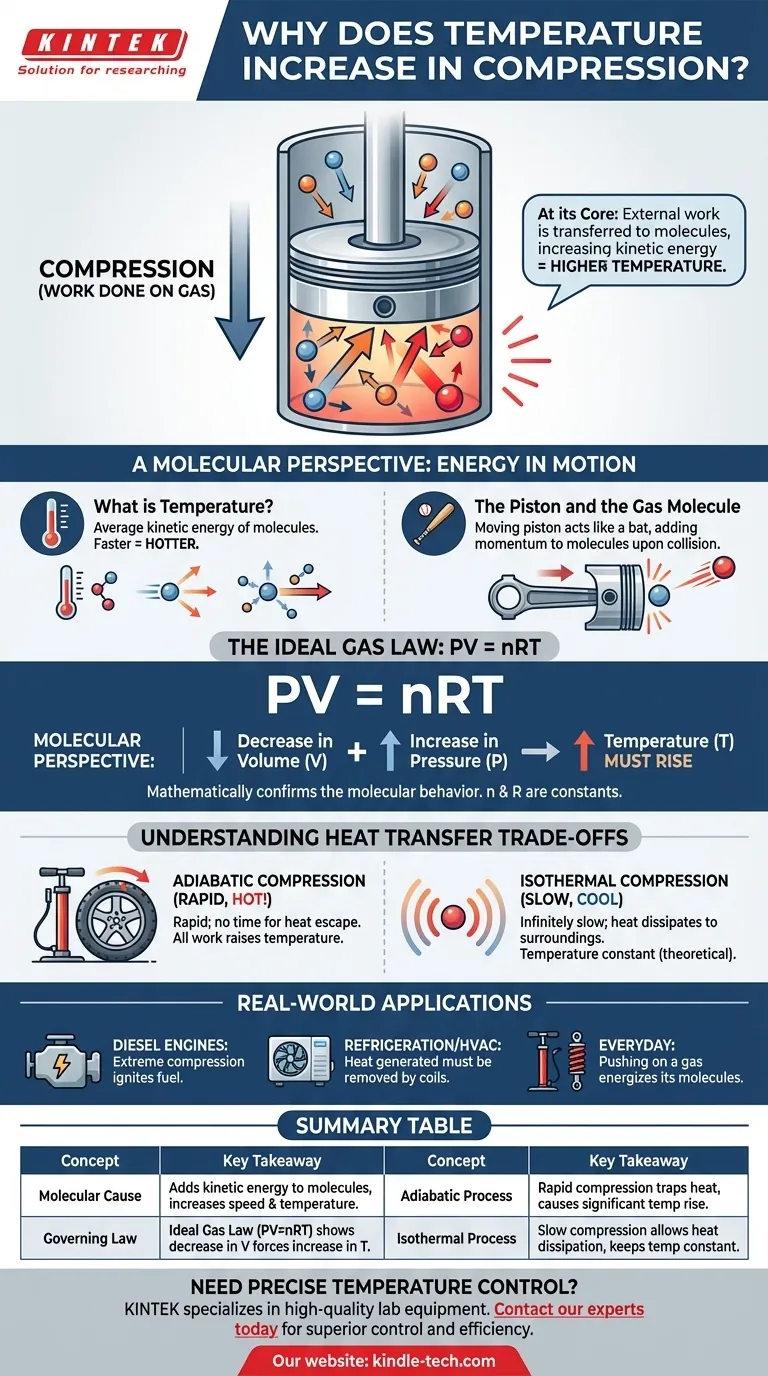
Im Grunde genommen erhöht die Kompression eines Gases dessen Temperatur, weil Arbeit an ihm verrichtet wird. Diese externe Arbeit wird direkt auf die Gasmoleküle übertragen, wodurch deren kinetische Energie zunimmt. Wir messen diese Zunahme der durchschnittlichen kinetischen Energie der Moleküle als Temperaturanstieg.
Der Akt der Kompression ist nicht nur eine Volumenreduzierung; es ist eine Energieinjektion. Die Kraft, die Sie zum Komprimieren des Gases aufwenden, fügt dessen Molekülen Energie hinzu, wodurch sie sich schneller bewegen, was wir als Wärme wahrnehmen.

Eine molekulare Perspektive: Energie in Bewegung
Um die Kompressionserwärmung wirklich zu verstehen, müssen wir darüber nachdenken, was auf der Ebene der einzelnen Moleküle geschieht. Die Temperatur eines Gases ist einfach ein Maß für die durchschnittliche Bewegung seiner unzähligen Teilchen.
Was ist Temperatur wirklich?
Temperatur ist eine makroskopische Messung der durchschnittlichen kinetischen Energie der Moleküle in einem System. Sich schneller bewegende Moleküle besitzen mehr kinetische Energie, was zu einer höheren Temperatur führt. Sich langsamer bewegende Moleküle bedeuten eine niedrigere Temperatur.
Der Akt der Kompression
Stellen Sie sich ein Gas vor, das in einem Zylinder mit einem beweglichen Kolben eingeschlossen ist. Um das Gas zu komprimieren, müssen Sie den Kolben physisch nach innen drücken und dabei Kraft über eine Strecke ausüben. Diese Handlung ist die wissenschaftliche Definition von Arbeit.
Der Kolben und das Gasmolekül
Stellen Sie sich den sich bewegenden Kolben als einen Schläger und ein Gasmolekül als einen Ball vor. Wenn ein Molekül mit einem stationären Kolben kollidiert, prallt es mit der gleichen Geschwindigkeit ab. Wenn es jedoch mit einem Kolben kollidiert, der sich nach innen bewegt, verleiht der Kolben dem Molekül Impuls und Energie, wodurch es mit größerer Geschwindigkeit zurückprallt.
Der kollektive Effekt
Dieser Energietransfer geschieht Milliarden Mal pro Sekunde bei allen Molekülen, die auf die Kolbenfläche treffen. Jede Kollision fügt ein winziges bisschen Energie hinzu. Das kumulative Ergebnis ist eine signifikante Zunahme der Durchschnittsgeschwindigkeit – und damit der durchschnittlichen kinetischen Energie – der gesamten Molekülpopulation, wodurch die Temperatur des Gases steigt.
Die Rolle des idealen Gasgesetzes
Dieses molekulare Verhalten wird mathematisch durch grundlegende physikalische Gesetze beschrieben, am einfachsten durch das ideale Gasgesetz. Es liefert eine übergeordnete Bestätigung dessen, was wir auf molekularer Ebene beobachten.
Die maßgebliche Gleichung: PV = nRT
Das ideale Gasgesetz setzt den Druck (P), das Volumen (V) und die Temperatur (T) einer gegebenen Gasmenge (n) in Beziehung. Das „R“ ist eine Konstante. Diese Gleichung zeigt, dass diese Eigenschaften untrennbar miteinander verbunden sind.
Wie das Gesetz das Ergebnis vorhersagt
Wenn Sie ein Gas komprimieren, verringern Sie sein Volumen (V). Die von Ihnen aufgebrachte Kraft erhöht auch seinen Druck (P). Damit die Gleichung PV = nRT im Gleichgewicht bleibt, muss eine Zunahme auf der linken Seite der Gleichung (durch die Kombination aus steigendem P und sinkendem V) durch eine Zunahme auf der rechten Seite ausgeglichen werden. Da n und R konstant sind, muss die Temperatur (T) steigen.
Die Abwägungen verstehen: Wärmeübertragung
Die Kompressionsrate verändert das Ergebnis dramatisch, da sie bestimmt, wie viel Zeit das System hat, mit seiner Umgebung zu interagieren.
Adiabatische Kompression (kein Wärmeentweichen)
Dies tritt auf, wenn die Kompression so schnell erfolgt, dass die erzeugte Wärme keine Zeit hat, in die Umgebung zu entweichen. Die gesamte von Ihnen geleistete Arbeit wird direkt in die Erhöhung der inneren Energie und Temperatur des Gases umgewandelt. Das Aufpumpen eines Fahrradreifens ist ein reales Beispiel; die Pumpe wird merklich heiß.
Isotherme Kompression (perfektes Wärmeentweichen)
Dies ist ein theoretisches Ideal, das auftritt, wenn die Kompression unendlich langsam erfolgt. Dieses langsame Tempo ermöglicht es, dass die gesamte durch die Arbeit erzeugte zusätzliche Wärme an die Umgebung abgeführt wird, wodurch die Temperatur des Gases konstant bleibt. Obwohl dies praktisch nicht erreichbar ist, ist es ein entscheidendes Konzept für die thermodynamische Analyse.
Das reale Szenario
Nahezu alle realen Prozesse fallen zwischen diese beiden Extreme. Ein Teil der geleisteten Arbeit erhöht die Innentemperatur, während ein Teil der erzeugten Wärme an die Umgebung verloren geht.
Wie man dieses Prinzip anwendet
Das Verständnis der Kompressionserwärmung ist nicht nur akademisch; es ist grundlegend für unzählige reale Anwendungen und Systeme.
- Wenn Ihr Hauptaugenmerk auf alltäglichen Phänomenen liegt: Denken Sie daran, dass das Drücken auf ein Gas (Arbeit leisten) seine Moleküle energetisiert, weshalb eine Fahrradpumpe oder ein Stoßdämpfer heiß wird.
- Wenn Ihr Hauptaugenmerk auf Motorkonstruktion liegt: Dieses Prinzip ist die Grundlage des Dieselmotors, der eine extreme Kompression nutzt, um die Luft so stark zu erhitzen, dass Kraftstoff ohne Zündkerze gezündet wird.
- Wenn Ihr Hauptaugenmerk auf Kühlung oder HLK liegt: Die während der Kompressionsphase eines Kältemittels erzeugte Wärme ist die Abwärme, die durch die Kondensatorspulen auf der Rückseite Ihres Kühlschranks oder in Ihrer Außeneinheit der Klimaanlage aktiv abgeführt werden muss.
Letztendlich ist die Verbindung zwischen mechanischer Arbeit und thermischer Energie ein fundamentales physikalisches Gesetz, das Kraft auf molekularer Ebene in Wärme umwandelt.
Zusammenfassungstabelle:
| Konzept | Wichtigste Erkenntnis |
|---|---|
| Molekulare Ursache | Kompression fügt den Gasmolekülen kinetische Energie hinzu, wodurch ihre Geschwindigkeit und Temperatur steigen. |
| Maßgebendes Gesetz | Das ideale Gasgesetz (PV=nRT) zeigt mathematisch, dass eine Volumenabnahme (V) eine Temperaturerhöhung (T) erzwingt. |
| Adiabatischer Prozess | Schnelle Kompression (z. B. Fahrradpumpe) schließt Wärme ein und führt zu einem deutlichen Temperaturanstieg. |
| Isothermer Prozess | Langsame, theoretische Kompression ermöglicht die Wärmeabfuhr und hält die Temperatur konstant. |
| Reale Auswirkungen | Grundlegend für Dieselmotoren, Kältekreisläufe und HLK-Systeme. |
Benötigen Sie eine präzise Temperaturkontrolle für Ihre Prozesse? Die Prinzipien der Thermodynamik sind entscheidend für Forschung und Entwicklung sowie für industrielle Anwendungen. KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien und bedient die anspruchsvollen Bedürfnisse von Laboren. Ob Sie neue Materialien entwickeln oder thermische Systeme optimieren – unser Fachwissen kann Ihre Arbeit unterstützen. Kontaktieren Sie noch heute unsere Experten, um zu besprechen, wie wir Ihnen helfen können, überlegene Kontrolle und Effizienz in Ihrem Labor zu erreichen.
Visuelle Anleitung
Ähnliche Produkte
- Warm Isostatisches Pressen WIP Arbeitsplatz 300 MPa für Hochdruckanwendungen
- Doppelplatten-Heizpresse für Labor
- Anti-Cracking-Pressform für Laboranwendungen
- Einzelstempel-Tablettenpresse und Rotations-Tablettenstanzmaschine für die Massenproduktion für TDP
- Einzelstempel-Elektro-Tablettenpressmaschine Laborpulver-Tablettenstanzmaschine TDP-Tablettenpresse
Andere fragen auch
- Welche Rolle spielt ein Magnetrührer bei der GO-Synthese? Präzisionskontrolle für den Erfolg der modifizierten Hummer-Methode
- Was sind die Vorteile der Röntgenfluoreszenzanalyse (RFA)? Erzielen Sie überlegene Genauigkeit mit der Prägepellet-Vorbereitung
- Was ist die häufigste Form der Wärmebehandlung? Glühen, Härten und Anlassen meistern
- Was bewirkt Sintern mit Metallen? Pulver in langlebige, komplexe Bauteile verwandeln
- Was ist der Prozess der Pyrolyse zu Bioöl? Ein Leitfaden zur Umwandlung von Biomasse in flüssigen Brennstoff
- Wie wähle ich eine Filterpresse aus? Passen Sie die richtige Technologie an Ihre Schlämme an, um optimale Ergebnisse zu erzielen
- Womit testen Juweliere Diamanten? Essentielle Werkzeuge für die genaue Diamantverifizierung
- Was ist der Zweck eines Inkubator-Schüttlers mit konstanter Temperatur? Master-Quercetin-Adsorption auf Nanokompositen



















