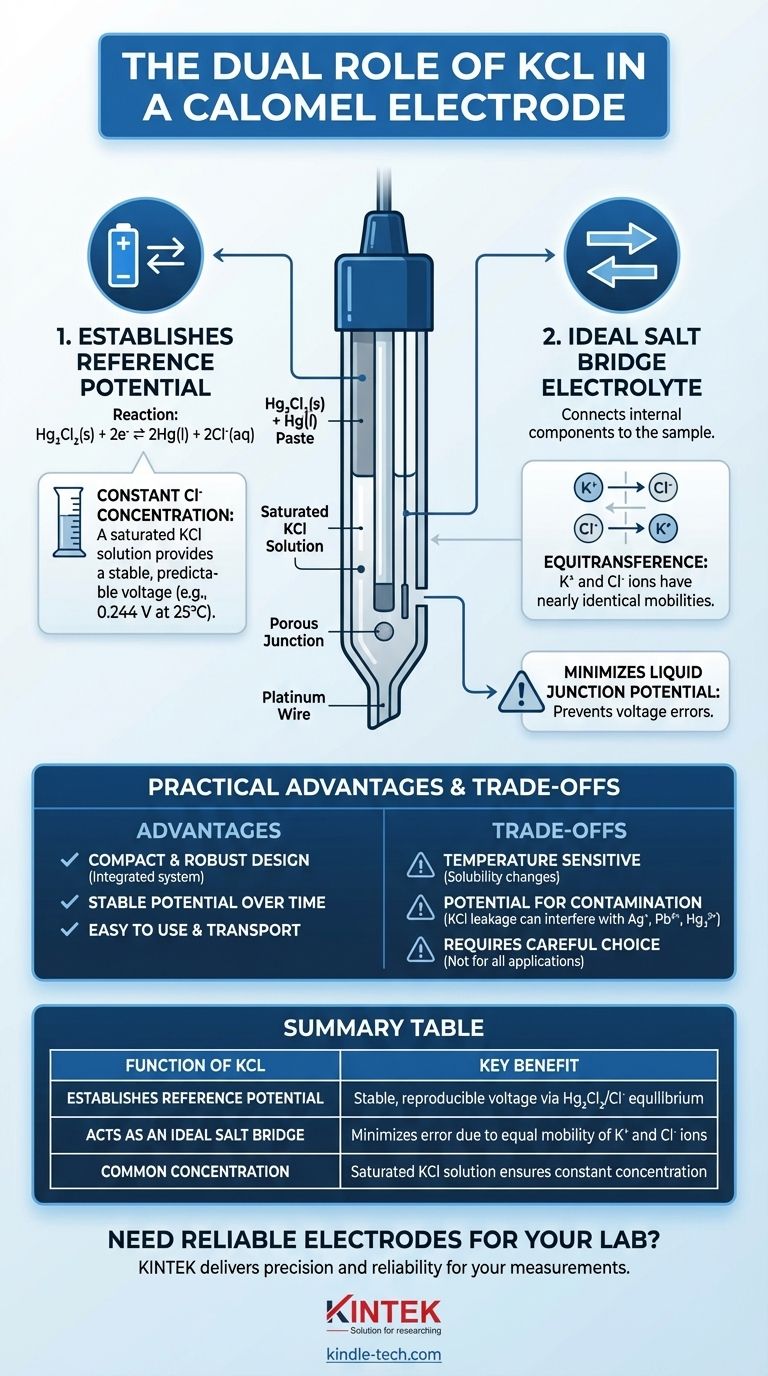
Im Kern wird Kaliumchlorid (KCl) in einer Kalomelelektrode aus zwei entscheidenden Gründen verwendet. Erstens ist das Chloridion (Cl⁻) eine Schlüsselkomponente in der chemischen Reaktion, die die stabile Spannung der Elektrode herstellt. Zweitens bewegen sich seine Kalium- (K⁺) und Chlorid- (Cl⁻) Ionen in Lösung mit nahezu identischen Geschwindigkeiten, was das definierende Merkmal eines idealen Salzbrückenelektrolyten ist.
Die Doppelfunktion von KCl ist der Schlüssel zum Erfolg der Kalomelelektrode. Es ist nicht nur eine passive Komponente; es beteiligt sich aktiv an der Festlegung des Referenzpotentials und verhindert gleichzeitig Messfehler, indem es als hochwirksame Salzbrücke fungiert.

Die doppelte Rolle von KCl in der Elektrodenfunktion
Die Wahl von KCl ist eine bewusste technische Entscheidung, um eine stabile, reproduzierbare und bequeme Referenzelektrode zu schaffen. Es dient zwei unterschiedlichen, aber gleichermaßen wichtigen Zwecken.
Festlegung des Referenzpotentials
Die Spannung einer Kalomelelektrode wird durch ein spezifisches chemisches Gleichgewicht erzeugt: Hg₂Cl₂(s) + 2e⁻ ⇌ 2Hg(l) + 2Cl⁻(aq).
Das Potential dieser Reaktion hängt direkt von der Konzentration der Chloridionen (Cl⁻) in der Lösung ab. Durch das Füllen der Elektrode mit einer KCl-Lösung bekannter und konstanter Konzentration wird ein stabiles und vorhersagbares Referenzpotential hergestellt.
Am häufigsten wird eine gesättigte KCl-Lösung verwendet. Dies stellt sicher, dass die Konzentration konstant bleibt, selbst wenn etwas Wasser verdunstet, und liefert eine hoch reproduzierbare Spannung, die sie zu einem zuverlässigen Maßstab für elektrochemische Messungen macht.
Funktion als ideale Salzbrücke
Die KCl-Lösung fungiert auch als Salzbrücke, die die internen Komponenten der Referenzelektrode mit der zu messenden Probenlösung verbindet.
Eine effektive Salzbrücke erfordert, dass ihre positiven und negativen Ionen mit nahezu gleichen Raten durch die Lösung wandern. Diese Eigenschaft wird als Äquimigration bezeichnet.
Wenn ein Ion deutlich schneller wandert als das andere, baut sich an der Grenze zwischen den beiden Lösungen eine Ladungstrennung auf. Dies erzeugt eine unerwünschte Spannung, bekannt als Diffusionspotential, die einen erheblichen Fehler in Ihre Messung einführt.
Die Beweglichkeiten von K⁺- und Cl⁻-Ionen sind nahezu identisch, was dieses Diffusionspotential minimiert und die Genauigkeit der Messung gewährleistet.
Praktische Vorteile und Kompromisse
Die Verwendung von KCl bringt erhebliche praktische Vorteile mit sich, führt aber auch zu Überlegungen, die jeder Analytiker verstehen muss.
Warum KCl praktisch ist
Die integrierte Natur von KCl – die sowohl der Elektrodenreaktion als auch der Salzbrücke dient – ermöglicht ein kompaktes und robustes Design.
Eine Kalomelelektrode benötigt keine separate, externe Salzbrücke. Dies erleichtert die Einrichtung, Verwendung und den Transport im Vergleich zu anderen Referenzsystemen. Ihr Potential ist auch bekanntermaßen über die Zeit sehr stabil.
Der Einfluss der Konzentration
Das Potential der Kalomelelektrode hängt vollständig von der KCl-Konzentration ab. Während gesättigtes KCl am häufigsten ist, werden auch andere Konzentrationen wie 1 M oder 0,1 M für spezifische Anwendungen verwendet.
Die Verwendung einer gesättigten Lösung ist praktisch, da die Konzentration selbstregulierend ist, aber es bedeutet auch, dass das Potential der Elektrode empfindlicher auf Temperaturänderungen reagiert, da sich die Löslichkeit von KCl mit der Temperatur ändert.
Kontaminationspotential
Ein kritischer Kompromiss ist, dass die Fülllösung der Elektrode langsam durch die poröse Verbindung in die Probe gelangen kann.
Wenn Ihre Analyse Ionen beinhaltet, die mit Chlorid ausfallen, wie Silber (Ag⁺), Blei (Pb²⁺) oder Quecksilber (Hg₂²⁺), kann das austretende KCl Störungen und ungenaue Ergebnisse verursachen.
Die richtige Wahl für Ihr Ziel treffen
Das Verständnis der Rolle von KCl hilft Ihnen zu bestimmen, wann eine Kalomelelektrode das richtige Werkzeug für Ihre spezifische elektrochemische Messung ist.
- Wenn Ihr Hauptaugenmerk auf Reproduzierbarkeit und Benutzerfreundlichkeit liegt: Eine gesättigte Kalomelelektrode (SCE) ist eine ausgezeichnete und klassische Wahl, vorausgesetzt, Ihre Probe ist frei von störenden Ionen und die Temperatur ist stabil.
- Wenn Ihr Hauptaugenmerk auf der Minimierung von Chloridkontamination liegt: Sie müssen ein anderes Referenzsystem verwenden, z. B. eine Quecksilber-Quecksilber(I)sulfat-Elektrode, die einen chloridfreien Elektrolyten verwendet.
- Wenn Ihr Hauptaugenmerk auf der Leistung bei unterschiedlichen Temperaturen liegt: Eine Elektrode mit einer ungesättigten KCl-Lösung (z. B. 3 M) bietet ein stabileres Potential bei Temperaturänderungen als eine gesättigte Version.
Letztendlich ist die Wahl von KCl grundlegend für das Design der Kalomelelektrode und bietet die stabile Basis, die für genaue und zuverlässige Messungen erforderlich ist.
Zusammenfassungstabelle:
| Funktion von KCl | Hauptvorteil |
|---|---|
| Stellt Referenzpotential her | Bietet eine stabile, reproduzierbare Spannung über das Hg₂Cl₂/Cl⁻-Gleichgewicht. |
| Wirkt als ideale Salzbrücke | Minimiert Messfehler aufgrund der nahezu gleichen Beweglichkeit von K⁺- und Cl⁻-Ionen. |
| Übliche Konzentration | Gesättigte KCl-Lösung gewährleistet konstante Konzentration und verbessert die Reproduzierbarkeit. |
Benötigen Sie eine zuverlässige Referenzelektrode für die elektrochemische Analyse Ihres Labors?
Bei KINTEK verstehen wir, dass die Genauigkeit Ihrer Messungen von hochwertiger Laborausrüstung abhängt. Unser Sortiment an Elektroden und Verbrauchsmaterialien wurde entwickelt, um die Präzision und Zuverlässigkeit zu liefern, die Ihr Labor benötigt.
Lassen Sie sich von unseren Experten bei der Auswahl der perfekten Ausrüstung für Ihre spezifische Anwendung helfen. Kontaktieren Sie KINTEK noch heute, um Ihre Anforderungen zu besprechen und den Erfolg Ihres Labors sicherzustellen!
Visuelle Anleitung
Ähnliche Produkte
- Referenzelektrode Kalomel Silberchlorid Quecksilbersulfat für Laborzwecke
- Rotierende Platindisk-Elektrode für elektrochemische Anwendungen
- Metall-Scheibenelektrode Elektrochemische Elektrode
- Platinblechelektrode für Labor- und Industrieanwendungen
- Goldplattierte Elektrode
Andere fragen auch
- Was ist die Funktion von Polyetheretherketon (PEEK) in Zirkoniumelektroden? Erhöhung der Präzision bei Korrosionsstudien
- Was sind die Hauptanwendungszwecke von Metalldrahtgeflechtmaterialien in Elektrolyseelektroden? Maximieren Sie Ihre katalytische Effizienz
- Was ist die Funktion der Platinelektrode in der SHE? Sie ist der inerte Katalysator für einen universellen Standard
- Wie verbessert die Verwendung einer Edelstahldrahtgitter-Gegenelektrode die LSV-Prüfung? Erhöhen Sie die Genauigkeit durch größere Oberfläche
- Wie sollte eine vorbehandelte Kohlenstofffaserbürste installiert werden? Gewährleistung einer zuverlässigen elektrochemischen Leistung
- Was sind die technischen Vorteile der Verwendung einer Sandwich-Elektrodenkonfiguration bei der Elektrogewinnung? Maximierung der Metallrückgewinnung
- Was leistet die Hilfselektrode? Sicherstellung präziser elektrochemischer Messungen
- Was ist das Funktionsprinzip einer Platindisktenelektrode? Ein Leitfaden für präzise elektrochemische Analysen