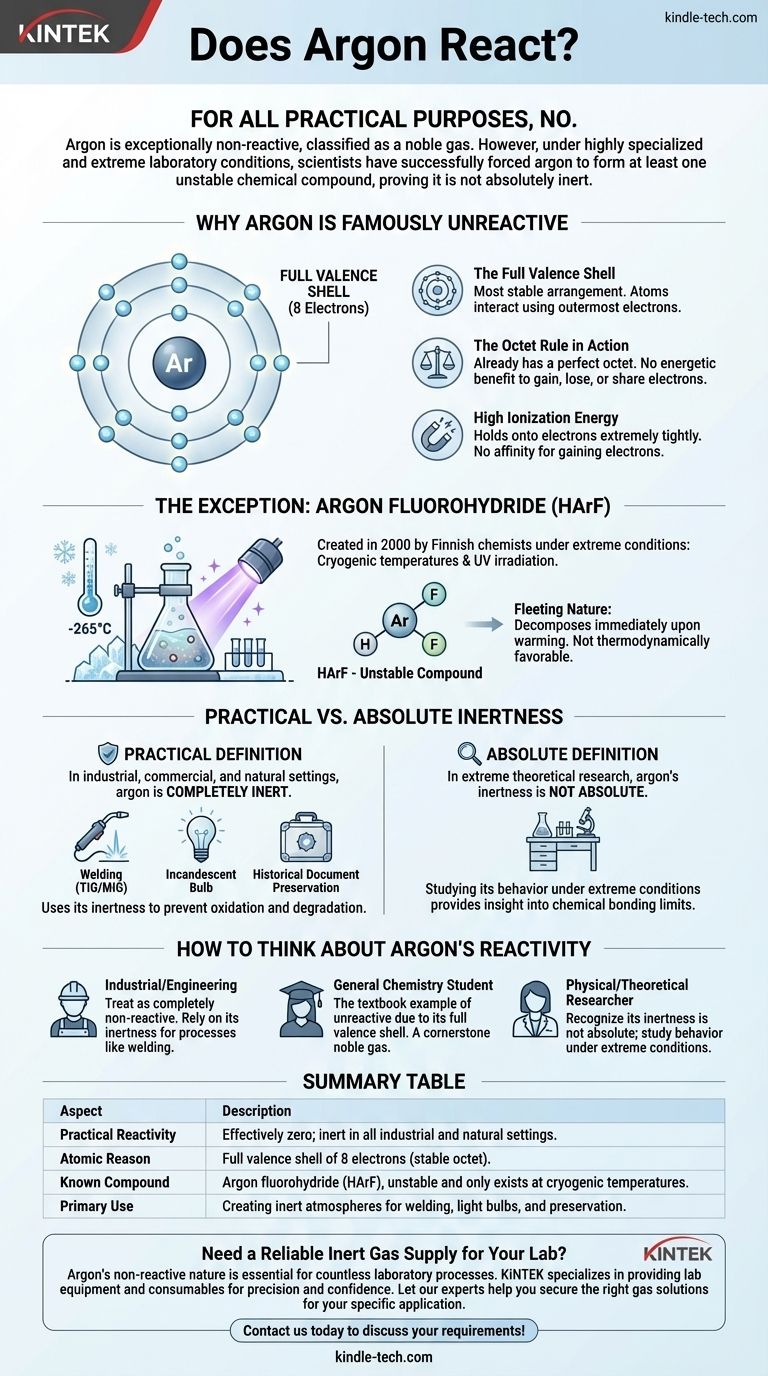
Für alle praktischen Zwecke: Nein. Argon ist außergewöhnlich unreaktiv, weshalb es als Edelgas klassifiziert wird. Unter hochspezialisierten und extremen Laborbedingungen ist es Wissenschaftlern jedoch gelungen, Argon zur Bildung von mindestens einer instabilen chemischen Verbindung zu zwingen, was beweist, dass es nicht absolut inert ist.
Die Kernbotschaft ist, dass die „Reaktivität“ eines Elements keine einfache Ja-oder-Nein-Frage ist. Während die perfekte Elektronenkonfiguration von Argon es in jedem natürlichen oder industriellen Kontext inert macht, kann seine Nichtreaktivität bei genügend Energie unter kryogenen Bedingungen überwunden werden, was die subtilen Komplexitäten chemischer Bindungen offenbart.

Warum Argon berühmt „unreaktiv“ ist
Um zu verstehen, warum Argon sich so stark gegen die Bildung chemischer Bindungen wehrt, müssen wir seine Atomstruktur betrachten. Sein Ruf als inert ist nicht willkürlich; er ist eine direkte Folge seiner Elektronenkonfiguration.
Die volle Valenzschale
Atome interagieren und bilden Bindungen mithilfe ihrer äußersten Elektronen, den sogenannten Valenzelektronen.
Argon besitzt acht Valenzelektronen, womit seine äußere Elektronenschale vollständig gefüllt ist. Dies ist die stabilste Anordnung, die ein Atom haben kann.
Die „Oktettregel“ in Aktion
Die „Oktettregel“ ist ein fundamentales Prinzip der Chemie, das besagt, dass Atome dazu neigen, Elektronen aufzunehmen, abzugeben oder zu teilen, um eine volle äußere Schale mit acht Elektronen zu erreichen.
Da Argon bereits dieses perfekte Oktett besitzt, gibt es keinen energetischen Vorteil für es, Elektronen mit anderen Atomen aufzunehmen, abzugeben oder zu teilen. Es befindet sich bereits in seinem idealen, energiearmen Zustand.
Hohe Ionisierungsenergie
Die Ionisierungsenergie ist die Energie, die benötigt wird, um ein Elektron aus einem Atom zu entfernen. Argon hat eine sehr hohe Ionisierungsenergie, was bedeutet, dass es seine Elektronen extrem fest hält.
Ebenso hat es keine Affinität, Elektronen aufzunehmen. Unter normalen Umständen gibt es einfach kein chemisches „Motiv“ für Argon, eine Reaktion einzugehen.
Die Ausnahme, die die Regel bestätigt
Jahrzehntelang glaubte man, Argon sei völlig inert. Dies änderte sich im Jahr 2000, als ein Team finnischer Chemiker die erste bekannte echte Argonverbindung herstellte.
Erzwingen einer Reaktion unter extremen Bedingungen
Die Verbindung, Argonfluorhydrid (HArF), wurde nicht in einem normalen Laborkolben erzeugt.
Wissenschaftler mussten ein Gemisch aus Argon und Fluorwasserstoff auf einer Oberfläche bei Temperaturen nahe dem absoluten Nullpunkt (etwa -265 °C oder -445 °F) einfrieren und es dann mit starkem ultraviolettem Licht bestrahlen. Dieser extreme Energieeintrag reichte aus, um das widerwillige Argonatom vorübergehend zu einer Bindung zu zwingen.
Die flüchtige Natur von Argonverbindungen
Die resultierende HArF-Verbindung ist unglaublich instabil. Sie existiert nur bei diesen kryogenen Temperaturen.
Wird sie auch nur geringfügig erwärmt, brechen die schwachen Bindungen und sie zersetzt sich sofort wieder in getrenntes Argon und Fluorwasserstoff. Dies verdeutlicht, dass die Verbindung thermodynamisch nicht begünstigt ist und nur existiert, weil sie durch die extreme Kälte „eingefangen“ wird.
Praktische Inertheit vs. absolute Inertheit
Diese Entdeckung zwingt uns, zwischen zwei Konzepten zu unterscheiden: was praktisch gilt und was absolut, theoretisch gilt.
Die praktische Definition von Inert
In jeder industriellen, kommerziellen oder natürlichen Umgebung ist Argon vollständig inert. Es reagiert nicht mit Luft, Wasser, Metallen oder irgendeiner anderen Substanz, mit der es in Kontakt kommt.
Diese praktische Inertheit macht es so wertvoll.
Warum dies für Anwendungen wichtig ist
Die Nichtreaktivität von Argon ist ein Vorteil, keine Einschränkung. Beim Schweißen (WIG/MIG) erzeugt es eine inerte „Schutzhülle“ um das geschmolzene Metall und verhindert, dass es oxidiert oder mit Gasen in der Luft reagiert, was eine saubere, starke Schweißnaht gewährleistet.
In Glühlampen verhindert eine Argonatmosphäre, dass der heiße Wolframfaden durchbrennt. Bei der Konservierung historischer Dokumente bietet es eine sauerstofffreie Umgebung, um den Verfall zu stoppen.
Wie man über die Reaktivität von Argon nachdenkt
Ihr Kontext bestimmt, wie Sie das chemische Verhalten von Argon betrachten sollten. Das Verständnis dieser Unterscheidung ist der Schlüssel zur korrekten Anwendung chemischer Prinzipien.
- Wenn Sie in einem industriellen oder technischen Umfeld arbeiten: Betrachten Sie Argon als ein vollständig nicht reaktives Gas. Seine Inertheit ist seine wertvollste Eigenschaft und kann für Prozesse wie Schweißen und Fertigung genutzt werden.
- Wenn Sie ein Student der allgemeinen Chemie sind: Verstehen Sie, dass Argon aufgrund seiner vollen Valenzelektronenschale das Lehrbuchbeispiel für ein unreaktives Element ist und somit ein Eckpfeiler der Edelgasgruppe darstellt.
- Wenn Sie ein Forscher in der physikalischen oder theoretischen Chemie sind: Erkennen Sie an, dass die Inertheit von Argon nicht absolut ist und die Untersuchung seines Verhaltens unter extremen Bedingungen wertvolle Einblicke in die Grenzen chemischer Bindungen bietet.
Letztendlich ist die extreme Reaktionsunlust von Argon eine grundlegende Eigenschaft, die es sowohl wissenschaftlich interessant als auch in der realen Welt immens nützlich macht.
Zusammenfassungstabelle:
| Aspekt | Beschreibung |
|---|---|
| Praktische Reaktivität | Effektiv null; inert in allen industriellen und natürlichen Umgebungen. |
| Atomare Ursache | Volle Valenzschale mit 8 Elektronen (stabiles Oktett). |
| Bekannte Verbindung | Argonfluorhydrid (HArF), instabil und existiert nur bei kryogenen Temperaturen. |
| Hauptanwendung | Erzeugung inerter Atmosphären für Schweißen, Glühlampen und Konservierung. |
Benötigen Sie eine zuverlässige Versorgung mit Inertgas für Ihr Labor?
Die nicht reaktive Natur von Argon ist für unzählige Laborprozesse unerlässlich, von der Schaffung kontrollierter Atmosphären bis hin zur Handhabung empfindlicher Materialien. Die Sicherstellung einer konstanten Versorgung mit hoher Reinheit ist entscheidend für Ihre Ergebnisse.
KINTEK ist spezialisiert auf die Bereitstellung der Laborgeräte und Verbrauchsmaterialien, die Sie für präzises und sicheres Arbeiten benötigen. Lassen Sie sich von unseren Experten helfen, die richtigen Gaslösungen für Ihre spezifische Anwendung zu finden.
Kontaktieren Sie uns noch heute über unser Formular, um Ihre Anforderungen zu besprechen!
Visuelle Anleitung
Ähnliche Produkte
- 10L Kühlkreislauf-Wasserbad Niedertemperatur-Konstanttemperatur-Reaktionsbad
- Aluminiumfolien-Stromabnehmer für Lithiumbatterien
- Labormaßstabs Induktionsschmelzofen mit Vakuum
- Tieftemperatur-wassergekühlter Vibrations-Feinstzerkleinerer mit Touchscreen
- Kundenspezifischer PTFE-Teflon-Teilehersteller Schleifschale
Andere fragen auch
- Für welche Arten von Substanzen sind Wasserbäder und Kühlgeräte ideal? Wesentliche Pflege für empfindliche Proben
- Warum ist ein Kühlkreislaufsystem oder eine Kühleinheit für SFE notwendig? Verhindert Gasverstopfung und gewährleistet Hochdruckfluss
- Was ist die Delta-20-Regel? Ein Leitfaden zur Diagnose und Perfektionierung Ihres Espressos
- Was ist die Bedeutung eines Umluftkühlwassersystems? Schützen Sie Ihr Labor und beherrschen Sie die Reaktionskontrolle
- Was ist der Zweck der Verwendung eines Kühlwassersystems nach der Vorbehandlung von Weizenstroh? Optimierung der Zuckerausbeute und Sicherheit














