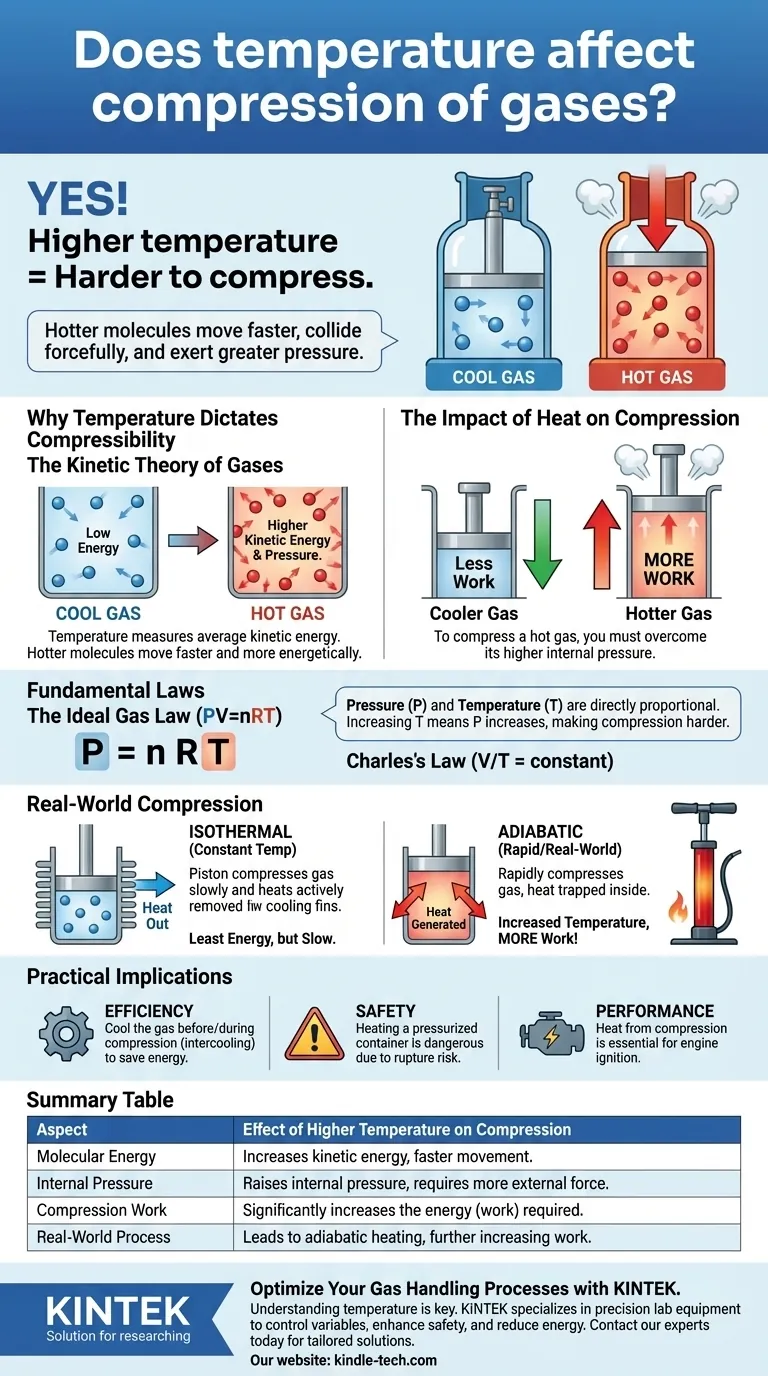
Ja, die Temperatur hat einen direkten und entscheidenden Einfluss auf die Kompression von Gasen. Ein Gas bei höherer Temperatur ist wesentlich schwerer zu komprimieren als dasselbe Gas bei niedrigerer Temperatur. Dies liegt daran, dass die Temperatur ein Maß für die kinetische Energie der Gasmoleküle ist; heißere Moleküle bewegen sich schneller, stoßen heftiger mit den Wänden ihres Behälters zusammen und üben daher einen größeren Druck aus, der überwunden werden muss.
Das Kernprinzip ist, dass die Kompression eines Gases Arbeit erfordert, um den von seinen Molekülen ausgeübten Druck zu überwinden. Da ein heißeres Gas bei gegebenem Volumen einen höheren Druck ausübt, ist mehr Arbeit erforderlich, um es zu komprimieren.

Warum die Temperatur die Kompressibilität bestimmt
Um die Beziehung zwischen Temperatur und Kompression zu verstehen, müssen wir das Verhalten der Gasmoleküle betrachten. Dies wird durch die kinetische Gastheorie erklärt.
Die kinetische Gastheorie
Die Temperatur ist eine makroskopische Messung der durchschnittlichen kinetischen Energie der Moleküle in einer Substanz. Höhere Temperaturen bedeuten, dass sich die einzelnen Gasmoleküle schneller und energischer bewegen.
Ein kühles Gas hat Moleküle mit geringerer durchschnittlicher kinetischer Energie, was bedeutet, dass sie sich langsamer bewegen. Ein heißes Gas hat Moleküle mit höherer durchschnittlicher kinetischer Energie, wodurch sie sich viel schneller bewegen.
Druck als Ergebnis molekularer Kollisionen
Der Druck, den ein Gas ausübt, ist das Ergebnis unzähliger Moleküle, die mit den Wänden ihres Behälters kollidieren. Jede Kollision überträgt eine kleine Kraft.
Wenn sich Moleküle heißer sind und sich schneller bewegen, treffen sie häufiger und mit größerer Kraft auf die Behälterwände, was zu einem höheren Druck führt.
Die Auswirkung von Wärme auf die Kompression
Die Kompression eines Gases bedeutet, seine Moleküle in ein kleineres Volumen zu zwingen. Um dies zu tun, müssen Sie einen äußeren Druck anwenden, der größer ist als der Innendruck des Gases.
Da ein heißes Gas von Natur aus einen höheren Innendruck ausübt, müssen Sie eine wesentlich größere äußere Kraft aufwenden, um es auf dasselbe Volumen wie ein kühleres Gas zu komprimieren.
Die zugrunde liegenden Gesetze
Diese Beziehung ist nicht nur theoretisch; sie wird durch grundlegende Gasgesetze, die die Grundlage der Thermodynamik bilden, präzise beschrieben.
Das ideale Gasgesetz (pV=nRT)
Das ideale Gasgesetz ist die vereinheitlichende Gleichung: Druck (P) × Volumen (V) = Stoffmenge des Gases (n) × Gaskonstante (R) × Temperatur (T).
Diese Gleichung zeigt, dass Druck und Temperatur direkt proportional sind. Wenn Sie das Volumen konstant halten und die Temperatur (T) erhöhen, muss auch der Druck (P) steigen. Dies bestätigt, warum ein heißeres Gas schwerer zu komprimieren ist – es beginnt bei einem höheren Druck oder baut diesen auf.
Das Gesetz von Charles (V/T = Konstante)
Das Gesetz von Charles besagt, dass bei einer festen Gasmenge bei konstantem Druck das Volumen direkt proportional zu seiner absoluten Temperatur ist.
Obwohl dies die Ausdehnung beim Erwärmen beschreibt, gilt das Umgekehrte gleichermaßen für die Kompression. Um bei Volumenreduzierung einen konstanten Druck aufrechtzuerhalten, müssten Sie die Temperatur proportional senken.
Praktische Realitäten und wichtige Kompromisse
In realen Anwendungen bringt der Kompressionsprozess selbst eine kritische Komplikation mit sich: Wärme.
Der idealisierte Fall: Isotherme Kompression
Die isotherme Kompression geht davon aus, dass die Temperatur des Gases während des gesamten Prozesses perfekt konstant gehalten wird.
Um dies zu erreichen, müssten Sie die durch die Kompression erzeugte Wärme aktiv und kontinuierlich abführen. Dieser Prozess erfordert die geringste Energiemenge (Arbeit), ist aber oft langsam und unpraktisch.
Der reale Fall: Adiabatische Kompression
Bei fast allen schnellen Kompressionsszenarien, wie in einem Motorzylinder oder einer Fahrradpumpe, nähert sich der Prozess der adiabatischen Kompression an. Das bedeutet, dass keine Wärme aus dem System entweichen kann.
Die gesamte Energie, die Sie in die Kompression des Gases stecken, erhöht dessen innere Energie, was zu einem schnellen und signifikanten Anstieg der Temperatur führt. Deshalb wird eine Reifenpumpe bei Gebrauch heiß.
Die Folge: Erhöhter Arbeitsaufwand
Diese adiabatische Erwärmung arbeitet Ihnen entgegen. Während Sie das Gas komprimieren, steigt seine Temperatur, was wiederum seinen Innendruck noch weiter erhöht.
Sie kämpfen nun gegen eine kontinuierlich zunehmende Gegenkraft. Deshalb erfordert die reale Kompression immer mehr Arbeit als das theoretische Ideal bei konstanter Temperatur. In der Industrie werden Mehrstufenkompressoren mit Zwischenkühlern speziell eingesetzt, um diesem Effekt entgegenzuwirken.
Die richtige Wahl für Ihr Ziel treffen
Das Verständnis dieser Beziehung ist entscheidend für Effizienz, Sicherheit und Leistung in jedem System, das komprimierte Gase beinhaltet.
- Wenn Ihr Hauptaugenmerk auf industrieller Effizienz liegt: Das Kühlen des Gases vor und während der Kompression (ein Prozess, der als Zwischenkühlung bekannt ist) reduziert den Energieaufwand für die Kompression dramatisch.
- Wenn Ihr Hauptaugenmerk auf Sicherheit liegt: Beachten Sie, dass das Erhitzen eines versiegelten, unter Druck stehenden Behälters extrem gefährlich ist, da der Innendruck proportional zur Temperatur ansteigt, was zu Berstrisiko führt.
- Wenn Ihr Hauptaugenmerk auf Motorleistung liegt: Die während des Verdichtungstakts eines Verbrennungsmotors erzeugte Wärme ist für die Zündung des Kraftstoff-Luft-Gemisches unerlässlich und wandelt diese thermische Energie in mechanische Arbeit um.
Letztendlich ist die Temperatur keine passive Variable, sondern ein aktiver Teilnehmer bei der Arbeit der Gasverdichtung.
Zusammenfassungstabelle:
| Aspekt | Auswirkung höherer Temperatur auf die Kompression |
|---|---|
| Molekulare Energie | Erhöht die kinetische Energie, wodurch sich die Moleküle schneller bewegen. |
| Innendruck | Erhöht den Innendruck des Gases, was eine stärkere äußere Kraft zur Kompression erfordert. |
| Kompressionsarbeit | Erhöht den für die Kompression erforderlichen Energieaufwand (Arbeit) erheblich. |
| Realer Prozess | Führt zu adiabatischer Erwärmung, was den Widerstand und den benötigten Arbeitsaufwand weiter erhöht. |
Optimieren Sie Ihre Gasbehandlungsprozesse mit KINTEK
Das Verständnis der kritischen Beziehung zwischen Temperatur und Gasverdichtung ist der Schlüssel zu Effizienz, Sicherheit und Leistung in jedem Labor- oder Industrieumfeld. Ob Sie ein neues System entwerfen oder ein bestehendes optimieren, die Steuerung thermischer Effekte ist von größter Bedeutung.
KINTEK ist spezialisiert auf präzise Laborgeräte und Verbrauchsmaterialien, die Ihnen helfen, diese Variablen zu kontrollieren. Von temperaturgesteuerten Umgebungen bis hin zu effizienten Kompressionssystemen sind unsere Lösungen darauf ausgelegt, den Arbeitsablauf sicherer zu machen und den Energieverbrauch zu senken.
Lassen Sie uns Ihnen helfen, überlegene Ergebnisse zu erzielen. Kontaktieren Sie noch heute unsere Experten über unser Kontaktformular, um zu besprechen, wie unsere maßgeschneiderten Lösungen Ihre spezifischen Laboranforderungen und Herausforderungen erfüllen können.
Visuelle Anleitung
Ähnliche Produkte
- Kundenspezifischer PTFE-Teflon-Teilehersteller für Luftventilanwendungen
- Kugelpressform für Labor
- Manuelle hydraulische Heizpresse mit beheizten Platten für Labor-Heißpresse
- Polygon-Pressform für Labor
- Automatische Labor-Heißpresse
Andere fragen auch
- Was sind die Bedingungen für die schnelle Pyrolyse? Maximierung der Bioöl-Ausbeute aus Biomasse
- Wie erleichtert ein Tisch-Orbital-Schüttler die Produktion von reduzierenden Zuckern? Steigert die Ausbeute der Zellulosehydrolyse
- Welche Temperatur ist zum Sintern von Stahl erforderlich? Optimieren Sie Ihren Prozess für Festigkeit und Präzision
- Wie hoch ist die maximale Temperatur für ein Ganzmetall-Hotend? Es liegt nicht am Metall, sondern an der Elektronik.
- Wie groß ist der Markt für chemische Gasphasenabscheidung? Prognostiziert wird ein Erreichen von 53,2 Milliarden US-Dollar bis 2028
- Sind einstufige Öfen zuverlässiger? Entdecken Sie die Wahrheit über die Haltbarkeit von HVAC-Anlagen im Vergleich zum Komfort.
- Wie stellen Sie den sicheren Betrieb von Geräten und Maschinen sicher? Ein proaktiver Leitfaden zum Risikomanagement
- Wie verbessern Vakuumpumpen Effizienz und Leistung? Steigern Sie die Geschwindigkeit Ihres Systems und senken Sie Kosten



















