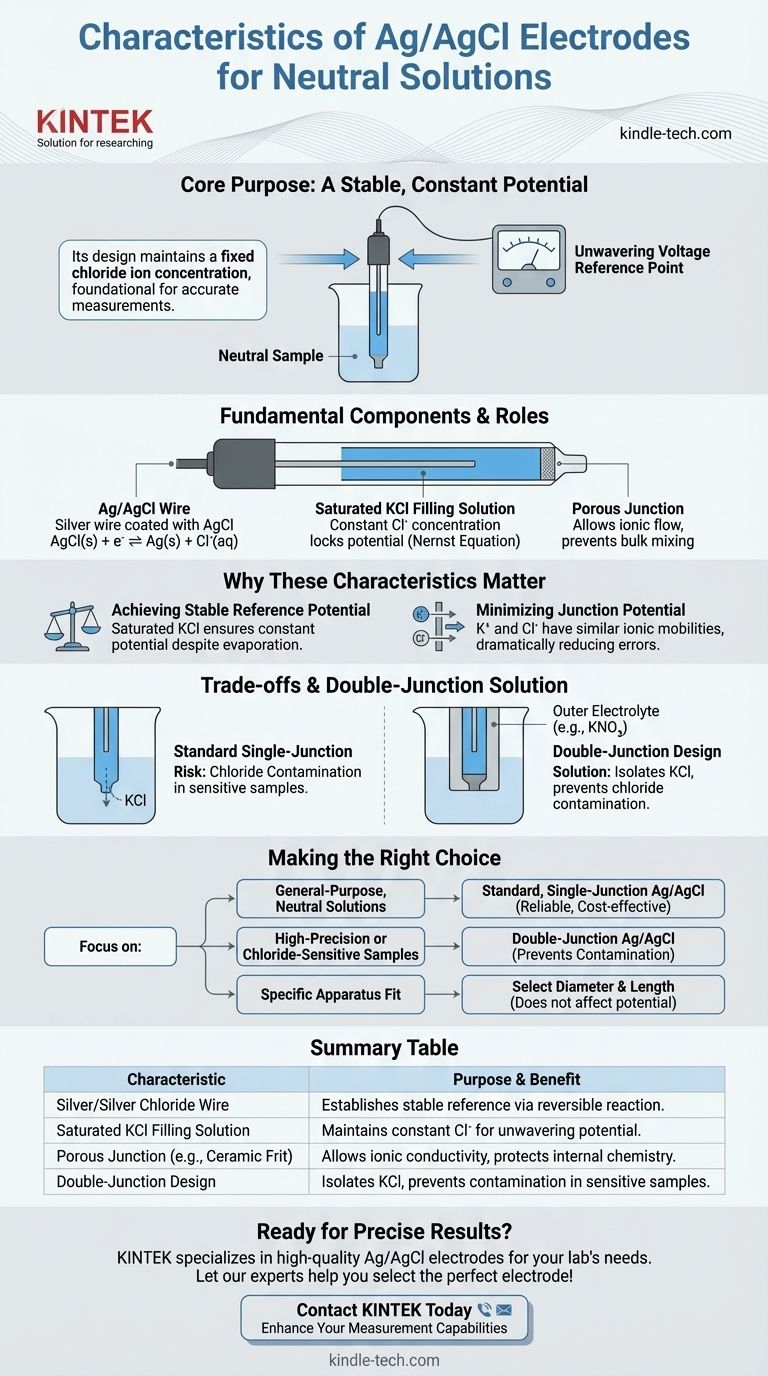
Im Kern ist eine Silber/Silberchlorid (Ag/AgCl)-Elektrode, die für neutrale Lösungen konzipiert ist, eine Referenzelektrode, die ein stabiles, konstantes Potenzial liefert. Ihr Hauptmerkmal ist die Verwendung eines mit Silberchlorid überzogenen Silberdrahtes, der in eine gesättigte Kaliumchlorid (KCl)-Lösung eingetaucht ist, um eine feste Chloridionenkonzentration aufrechtzuerhalten.
Der Zweck einer Ag/AgCl-Elektrode besteht nicht darin, mit Ihrer Probe zu reagieren, sondern einen unerschütterlichen, bekannten Spannungsmittelpunkt bereitzustellen. Ihr Aufbau, der sich um eine gesättigte KCl-Lösung dreht, gewährleistet diese Stabilität, die die Grundlage für jede genaue elektrochemische Messung bildet.

Die grundlegenden Komponenten und ihre Rolle
Um die Leistung der Elektrode zu verstehen, müssen Sie zunächst ihren Aufbau verstehen. Jedes Teil erfüllt eine präzise Funktion, um ein stabiles Potenzial zu gewährleisten.
Das Silber/Silberchlorid-Element
Das Herzstück der Elektrode ist ein reiner Silberdraht, der mit einer Schicht Silberchlorid (AgCl) überzogen ist. An diesem Element findet die grundlegende elektrochemische Reaktion statt.
Das Potenzial wird durch das Gleichgewicht zwischen dem festen Silber/Silberchlorid und den Chloridionen (Cl⁻) in der Fülllösung festgelegt: AgCl(s) + e⁻ ⇌ Ag(s) + Cl⁻(aq).
Die gesättigte KCl-Fülllösung
Für den Einsatz in neutralen Lösungen wird die Elektrode mit einer gesättigten Kaliumchlorid (KCl)-Lösung gefüllt. Dies ist das wichtigste Merkmal für die Stabilität.
Da die Lösung gesättigt ist, wird die Konzentration der Chloridionen auf einem bekannten, hohen Niveau konstant gehalten. Gemäß der Nernst-Gleichung fixiert diese konstante Chloridkonzentration das Potenzial der Elektrode und macht sie zu einer zuverlässigen Referenz.
Die poröse Junction (Verbindung)
Eine poröse Sinterglasfritte, typischerweise aus Keramik oder Quarz, trennt die innere Fülllösung von der äußeren Probenlösung.
Diese Junction ermöglicht den Ionenfluss zwischen der Elektrode und der Probe und vervollständigt so den Stromkreis. Sie verhindert jedoch das Durchmischen der beiden Lösungen, wodurch die innere Chemie der Referenzelektrode geschützt wird.
Warum diese Eigenschaften für Ihre Messung wichtig sind
Die spezifischen Komponenten einer Ag/AgCl-Elektrode sind bewusst gewählt, um häufige Probleme in der Elektrochemie zu lösen und sicherzustellen, dass Ihre Ergebnisse genau und reproduzierbar sind.
Erreichen eines stabilen Referenzpotenzials
Der gesamte Zweck einer Referenzelektrode besteht darin, ein Potenzial zu haben, das sich während Ihres Experiments nicht ändert.
Durch die Verwendung einer gesättigten KCl-Lösung bleibt die Chloridkonzentration konstant, selbst wenn eine kleine Menge Wasser verdunstet oder diffundiert. Diese konstante Konzentration gewährleistet ein felsenfeste Referenzpotenzial, gegen das Sie Ihre Arbeitselektrode messen können.
Minimierung des Junction-Potenzials
Eine Hauptfehlerquelle bei elektrochemischen Messungen ist das flüssige Junction-Potenzial. Dies ist eine kleine Spannung, die sich an der Grenzfläche zwischen der Fülllösung und Ihrer Probenlösung aufgrund unterschiedlicher Diffusionsgeschwindigkeiten der Ionen entwickelt.
Kaliumchlorid (KCl) wird speziell verwendet, weil die Ionenbeweglichkeiten des Kaliumions (K⁺) und des Chloridions (Cl⁻) nahezu identisch sind. Diese Ähnlichkeit führt dazu, dass sie mit fast der gleichen Geschwindigkeit über die Junction diffundieren, was das Junction-Potenzial drastisch minimiert und die Messgenauigkeit verbessert.
Verständnis der Kompromisse und Variationen
Obwohl die Standard-Ag/AgCl-Elektrode ein Arbeitstier ist, ist sie nicht universell perfekt. Das Verständnis ihrer Grenzen ist der Schlüssel zur Vermeidung von Messfehlern.
Das Risiko der Chloridkontamination
Der Hauptkompromiss besteht darin, dass unweigerlich eine kleine Menge der KCl-Fülllösung aus der porösen Junction in Ihre Probe austritt.
Bei den meisten neutralen Lösungen ist dies kein Problem. Wenn Ihr Experiment jedoch empfindlich auf Chloridionen reagiert – zum Beispiel, wenn Sie niedrige Chloridkonzentrationen messen oder mit Proben arbeiten, die mit Chlorid ausfallen (wie Silbernitrat) – führt dieses Auslaufen zu erheblichen Fehlern.
Die Rolle der Doppelsalzbrücken-Elektrode
Um das Problem der Chloridkontamination zu lösen, wird eine Doppelsalzbrücken-Elektrode verwendet. Dieses Design verfügt über eine zweite äußere Kammer, die die KCl-Lösung von der Probe isoliert.
Diese äußere Kammer kann mit einem nicht störenden Elektrolyten wie Kaliumnitrat (KNO₃) oder Natriumsulfat (Na₂SO₄) gefüllt werden. Sie bietet die Ionenbrücke zur Probe, ohne Chloridionen einzubringen, wodurch die Integrität Ihrer Probe gewahrt bleibt.
Physikalische Designaspekte
Elektroden sind in verschiedenen Durchmessern (z. B. 4 mm, 6 mm, 10 mm) und Längen erhältlich. Diese physikalischen Eigenschaften beeinflussen das Potenzial der Elektrode nicht, werden aber basierend auf den Einschränkungen Ihrer elektrochemischen Zelle, dem Volumen Ihrer Probe und der erforderlichen Haltbarkeit ausgewählt.
Die richtige Wahl für Ihr Ziel treffen
Die Auswahl der richtigen Elektrode ist ein entscheidender Schritt, um zuverlässige Daten zu erhalten. Ihre Wahl hängt direkt von der chemischen Beschaffenheit Ihrer Probe ab.
- Wenn Ihr Hauptaugenmerk auf allgemeinen Messungen in neutralen Lösungen liegt: Eine Standard-Ag/AgCl-Elektrode mit einfacher Junction und gesättigtem KCl ist die zuverlässige und kostengünstige Wahl.
- Wenn Ihr Hauptaugenmerk auf hochpräzisen Messungen oder chloridempfindlichen Proben liegt: Sie müssen eine Ag/AgCl-Elektrode mit Doppelsalzbrücke verwenden, um eine Probenkontamination zu verhindern und die Datenintegrität zu gewährleisten.
- Wenn Ihr Hauptaugenmerk auf der Anpassung an ein bestimmtes Gerät liegt: Wählen Sie den Elektroden-Durchmesser und die Länge, die physisch zur Konstruktion Ihrer elektrochemischen Zelle passen.
Zu verstehen, wie diese Komponenten eine stabile Referenz erzeugen, ist der Schlüssel zur Gewinnung vertrauenswürdiger und reproduzierbarer elektrochemischer Ergebnisse.
Zusammenfassungstabelle:
| Eigenschaft | Zweck & Nutzen |
|---|---|
| Silber/Silberchlorid-Draht | Kernglied; etabliert ein stabiles Referenzpotenzial durch eine reversible Reaktion. |
| Gesättigte KCl-Fülllösung | Hält eine konstante Chloridionenkonzentration für ein unerschütterliches Potenzial aufrecht, selbst bei geringer Verdunstung. |
| Poröse Junction (z. B. Keramikfritte) | Ermöglicht Ionenleitfähigkeit und verhindert gleichzeitig das Durchmischen der Lösungen, wodurch die innere Chemie geschützt wird. |
| Doppelsalzbrücken-Design (Variation) | Isoliert KCl von der Probe mithilfe eines intermediären Elektrolyten, um eine Chloridkontamination in empfindlichen Proben zu verhindern. |
Bereit für präzise und zuverlässige elektrochemische Ergebnisse?
Die richtige Referenzelektrode ist grundlegend für den Erfolg Ihres Labors. KINTEK ist spezialisiert auf hochwertige Laborgeräte, einschließlich einer Reihe von Ag/AgCl-Elektroden, die für Genauigkeit und Haltbarkeit in neutralen Lösungen entwickelt wurden. Ob Sie ein Standardmodell mit einfacher Junction für den allgemeinen Gebrauch oder eine Elektrode mit Doppelsalzbrücke für chloridempfindliche Anwendungen benötigen, wir haben die Lösung, um Ihre spezifischen Laboranforderungen zu erfüllen.
Lassen Sie sich von unseren Experten bei der Auswahl der perfekten Elektrode für Ihre Experimente helfen. Kontaktieren Sie KINTEK noch heute, um Ihre Anforderungen zu besprechen und Ihre Messfähigkeiten zu erweitern!
Visuelle Anleitung
Ähnliche Produkte
- Referenzelektrode Kalomel Silberchlorid Quecksilbersulfat für Laborzwecke
- Rotierende Platindisk-Elektrode für elektrochemische Anwendungen
- Metall-Scheibenelektrode Elektrochemische Elektrode
- Goldplattierte Elektrode
- Graphit-Scheiben-Stab- und Plattenelektrode Elektrochemische Graphitelektrode
Andere fragen auch
- Was sind die vier Haupttypen von Sensoren? Ein Leitfaden zu Stromquelle und Signaltyp
- Was sind die Eigenschaften einer gesättigten Kalomelelektrode für neutrale Lösungen? Stabilität und Einschränkungen verstehen.
- Warum und wie sollten die Elektroden einer Elektrolysezelle kalibriert werden? Zuverlässige Ergebnisse sichern
- Welche Art von Elektrode kann als Referenzpunkt verwendet werden? Wählen Sie die richtige für genaue Messungen
- Warum wird eine gesättigte Kalomelelektrode (SCE) als Referenzelektrode in der Forschung zu mikrobiellen Brennstoffzellen verwendet?



















