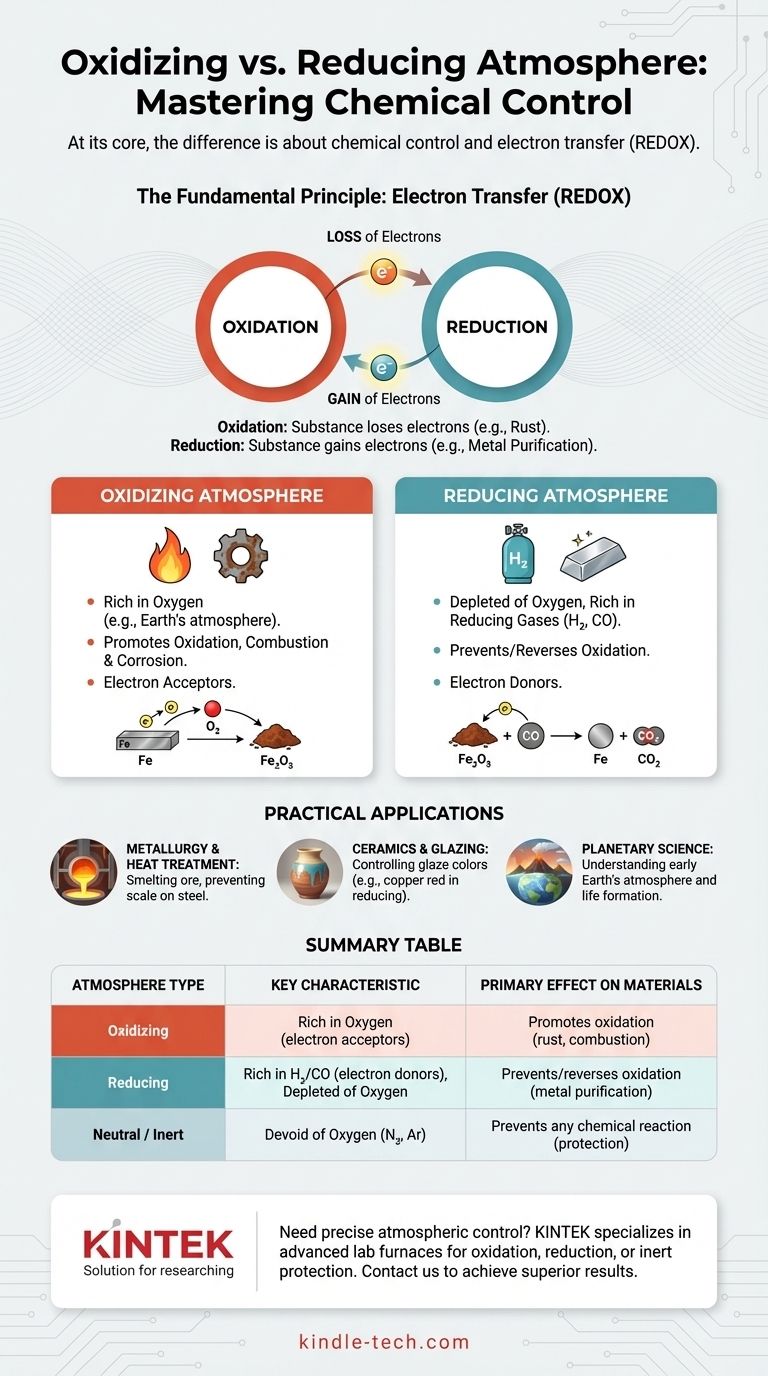
Im Kern liegt der Unterschied in der chemischen Kontrolle. Eine oxidierende Atmosphäre ist reich an Sauerstoff oder anderen Substanzen, die Elektronen aufnehmen, was Reaktionen wie Verbrennung und Korrosion fördert. Im direkten Gegensatz dazu ist eine reduzierende Atmosphäre absichtlich sauerstoffarm und enthält oft Gase wie Wasserstoff oder Kohlenmonoxid, die Elektronen abgeben, was die Oxidation verhindert oder sogar umkehrt.
Der Schlüsselunterschied liegt nicht nur in der Anwesenheit von Sauerstoff, sondern darin, ob die Chemie der Atmosphäre dazu führt, dass ein Material Elektronen verliert (Oxidation) oder Elektronen aufnimmt (Reduktion). Die Wahl der richtigen Atmosphäre ist grundlegend für die Kontrolle des Ergebnisses von Hochtemperaturprozessen, von der Herstellung von Stahl bis zum Brennen von künstlerischer Keramik.

Das Grundprinzip: Elektronentransfer
Um den Unterschied wirklich zu verstehen, müssen Sie über die Gase hinausblicken und sich auf die zugrunde liegende Chemie des Elektronenaustauschs konzentrieren. Dies wird als REDOX (Reduktion-Oxidation) bezeichnet.
Verständnis der Oxidation: Der Verlust von Elektronen
Oxidation ist ein chemischer Prozess, bei dem eine Substanz Elektronen verliert. Obwohl Sauerstoff das bekannteste Oxidationsmittel ist, ist er nicht das einzige.
Das klassische Beispiel ist Rost. Wenn Eisen einer sauerstoffreichen Atmosphäre ausgesetzt wird, verlieren die Eisenatome Elektronen an die Sauerstoffatome, wodurch Eisenoxid entsteht. Das Material wurde oxidiert.
Verständnis der Reduktion: Die Aufnahme von Elektronen
Reduktion ist der genau entgegengesetzte Prozess: Eine Substanz nimmt Elektronen auf. Dies „reduziert“ ihren Oxidationszustand.
In einer reduzierenden Atmosphäre sind Gase wie Wasserstoff (H₂) oder Kohlenmonoxid (CO) vorhanden. Diese Gase sind Elektronendonatoren; sie geben ihre Elektronen leicht an andere Substanzen ab und kehren so den Prozess der Oxidation um.
Eigenschaften jeder Umgebung
Die Zusammensetzung der Atmosphäre bestimmt direkt ihr chemisches Verhalten und ihre Wirkung auf die darin befindlichen Materialien.
Die Oxidierende Atmosphäre
Eine oxidierende Umgebung ist durch eine Fülle von freiem Sauerstoff oder anderen Oxidationsmitteln gekennzeichnet. Die Erdatmosphäre ist das häufigste Beispiel.
Diese Umgebung unterstützt und beschleunigt die Verbrennung. Sie ist auch der Haupttreiber für Korrosion und Zersetzung vieler Materialien, insbesondere von Metallen bei hohen Temperaturen.
Die Reduzierende Atmosphäre
Eine reduzierende Atmosphäre ist durch das nahezu vollständige Fehlen von Sauerstoff definiert. Um aktiv „reduzierend“ zu sein, muss sie auch reduzierende Gase enthalten.
Diese Gase, wie Wasserstoff oder Kohlenmonoxid, entziehen chemisch Sauerstoffatome von Materialien, mit denen sie in Kontakt kommen. Dies ist unerlässlich für Prozesse wie das Schmelzen von Erz zu reinem Metall.
Die Neutrale (oder Inert-) Atmosphäre
Es ist wichtig, einen dritten Zustand zu erkennen: eine neutrale oder inerte Atmosphäre. Diese Umgebung, die typischerweise aus Stickstoff oder Argon besteht, ist ebenfalls frei von Sauerstoff.
Im Gegensatz zu einer reduzierenden Atmosphäre spenden diese Gase jedoch keine aktiven Elektronen. Ihr Zweck ist es lediglich, Sauerstoff zu verdrängen und jegliche chemische Reaktion zu verhindern, wodurch das Material geschützt wird, ohne es zu verändern.
Praktische Auswirkungen und warum es wichtig ist
Die Wahl zwischen diesen Atmosphären ist nicht akademisch; es ist eine kritische Entscheidung in unzähligen industriellen und wissenschaftlichen Prozessen.
In der Metallurgie und Wärmebehandlung
Beim Schmelzen von Eisenerz wird ein Hochofen mit Koks (einer Form von Kohlenstoff) gefüllt, der verbrennt und eine kohlenmonoxidreiche, sauerstoffarme reduzierende Atmosphäre erzeugt. Das CO entzieht dem Eisenoxid-Erz den Sauerstoff und reduziert es zu reinem flüssigem Eisen.
Ebenso wird beim Wärmebehandeln von Stahl eine reduzierende Atmosphäre verwendet, um die Bildung von „Zunder“ (einer Schicht aus Eisenoxid) auf der heißen Oberfläche des Metalls zu verhindern.
In der Keramik und Glasur
Die Atmosphäre im Inneren eines Brennofens hat einen tiefgreifenden Einfluss auf die endgültige Farbe von Keramikglasuren.
Eine Kupferkarbonatglasur beispielsweise wird in einer oxidierenden Atmosphäre grün. In einer reduzierenden Atmosphäre erzeugt dieselbe Glasur ein brillantes Rot, da das Kupferoxid chemisch wieder zu reinem Kupfer „reduziert“ wird.
In der Planetologie
Die Unterscheidung ist auch entscheidend für das Verständnis der Planetenentstehung. Die frühe Erde hatte eine reduzierende Atmosphäre, was eine notwendige Bedingung für die Bildung der komplexen organischen Moleküle war, die zum Leben führten.
Erst nach der Entwicklung photosynthetischer Organismen entwickelte unser Planet die sauerstoffreiche, oxidierende Atmosphäre, auf die wir heute angewiesen sind.
Die richtige Wahl für Ihr Ziel treffen
Ihre Wahl wird ausschließlich durch die chemische Umwandlung bestimmt, die Sie erreichen müssen.
- Wenn Ihr Hauptaugenmerk darauf liegt, Korrosion zu verhindern oder Sauerstoff aus einer Verbindung zu entfernen (wie beim Schmelzen von Erz): Sie benötigen eine reduzierende Atmosphäre, die reich an Agenzien wie Kohlenmonoxid oder Wasserstoff ist.
- Wenn Ihr Hauptaugenmerk auf vollständiger Verbrennung oder der Erzeugung eines spezifischen chemischen Oxids liegt: Sie benötigen eine oxidierende Atmosphäre mit einer kontrollierten Sauerstoffzufuhr.
- Wenn Ihr Hauptaugenmerk einfach darauf liegt, ein Material bei hohen Temperaturen vor jeglicher chemischer Veränderung zu schützen: Sie sollten eine neutrale oder inerte Atmosphäre verwenden, wie reines Argon oder Stickstoff.
Letztendlich bedeutet die Beherrschung der atmosphärischen Bedingungen, dass Sie den Endzustand und die Integrität Ihres Materials beherrschen.
Zusammenfassungstabelle:
| Atmosphärenart | Schlüsselmerkmal | Hauptwirkung auf Materialien | Häufige Anwendungen |
|---|---|---|---|
| Oxidierend | Reich an Sauerstoff (Elektronenakzeptoren) | Fördert Oxidation (z. B. Rost, Verbrennung) | Vollständige Verbrennung, Erzeugung spezifischer Oxide |
| Reduzierend | Sauerstoffarm, reich an H₂/CO (Elektronendonatoren) | Verhindert/kehrt Oxidation um (z. B. Metallreinigung) | Erzschmelze, Verhinderung von Zunder auf Stahl, Keramik-Farbeffekte |
| Neutral/Inert | Sauerstofffrei (z. B. N₂, Ar) | Verhindert jegliche chemische Reaktion | Schutz von Materialien vor Veränderung bei hohen Temperaturen |
Benötigen Sie eine präzise atmosphärische Kontrolle für Ihre Laborprozesse? Die richtige Ofenatmosphäre ist entscheidend für die Erzielung der gewünschten Materialeigenschaften, sei es bei der Wärmebehandlung von Metallen, der Entwicklung neuer Keramiken oder dem Schutz empfindlicher Proben. KINTEK ist spezialisiert auf fortschrittliche Laboröfen und Geräte, die für eine exakte atmosphärische Kontrolle ausgelegt sind. Unsere Experten helfen Ihnen bei der Auswahl der perfekten Lösung, um die Oxidations-, Reduktions- oder Inertschutz für Ihre spezifische Anwendung zu gewährleisten. Kontaktieren Sie KINTEK noch heute, um Ihre Laboranforderungen zu besprechen und überlegene Ergebnisse zu erzielen.
Visuelle Anleitung
Ähnliche Produkte
- 1200℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- 1700℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- 1400℃ Kammerofen mit kontrollierter Atmosphäre und Stickstoff- und Inertgasatmosphäre
- Vertikaler Labortiegelofen
- Kontrollierter Hochtemperatur-Wasserstoff-Ofen
Andere fragen auch
- Welche Gase werden in inerten Atmosphären verwendet? Wählen Sie das richtige Gas für nicht-reaktive Umgebungen
- Was ist ein Beispiel für eine inerte Atmosphäre? Entdecken Sie das beste Gas für Ihren Prozess
- Kann Stickstoff zum Löten verwendet werden? Wichtige Bedingungen und Anwendungen erklärt
- Warum wird Stickstoff in Glühöfen verwendet? Um Oxidation und Entkohlung für eine überlegene Metallqualität zu verhindern
- Kann Stickstoffgas erhitzt werden? Nutzen Sie die inerte Hitze für Präzision und Sicherheit



















