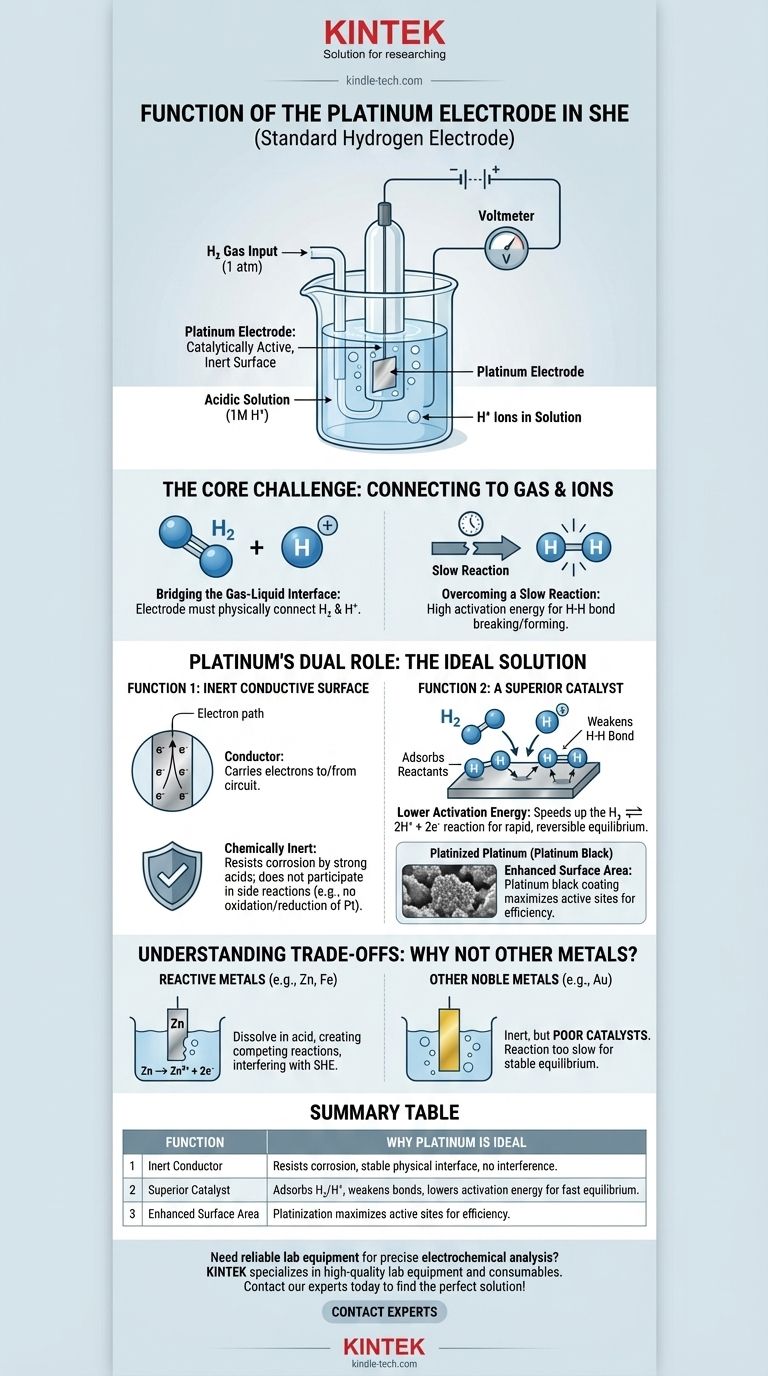
Kurz gesagt, die Platinelektrode in einer Standard-Wasserstoffelektrode (SHE) fungiert als katalytisch aktive, inerte Oberfläche. Sie bietet die physikalische Stelle, an der die Wasserstoffreaktion stattfinden kann, und senkt die erforderliche Aktivierungsenergie, wodurch die Zelle ein stabiles, messbares Gleichgewicht erreichen kann, ohne dass die Elektrode selbst verbraucht wird.
Die Kernherausforderung der SHE besteht darin, eine zuverlässige elektrische Verbindung zu einer Reaktion herzustellen, an der ein Gas (H₂) und ein Ion (H⁺) beteiligt sind. Platin ist für diese Rolle einzigartig geeignet, da es sowohl ein ausgezeichneter Katalysator für die Wasserstoffreaktion als auch ein chemisch inerter Leiter ist, wodurch sichergestellt wird, dass es die Reaktion erleichtert, ohne sie zu stören.

Die Kernherausforderung: Eine Schaltung mit einem Gas verbinden
Um die Funktion von Platin zu verstehen, müssen wir zunächst das grundlegende Problem beim Aufbau einer Standard-Wasserstoffelektrode erkennen. Das Ziel ist die Messung des Potentials der Wasserstoff-Redoxreaktion: 2H⁺(aq) + 2e⁻ ⇌ H₂(g).
Die Gas-Flüssigkeits-Grenzfläche überbrücken
Die Reaktion beinhaltet Wasserstoffionen, die in einer sauren Lösung gelöst sind, und Wasserstoffgas, das über die Elektrode geleitet wird. Eine Elektrode muss physisch in dieser Umgebung existieren, um Elektronen entweder an einen externen Stromkreis abzugeben oder von ihm aufzunehmen.
Eine langsame Reaktion überwinden
Diese Wasserstoffreaktion läuft von selbst nicht schnell oder effizient ab. Die Energie, die benötigt wird, um die H-H-Bindung in einem Wasserstoffmolekül zu brechen oder zwei Wasserstoffionen zu kombinieren, ist hoch. Ohne Hilfe würde das System kein schnelles und reversibles Gleichgewicht erreichen, was es als Standardreferenz unbrauchbar machen würde.
Platins Doppelrolle: Die ideale Lösung
Platin wird gewählt, weil es beide Probleme gleichzeitig löst. Es wirkt sowohl als inerter physikalischer Leiter als auch als aktiver chemischer Katalysator.
Funktion 1: Eine inerte leitfähige Oberfläche
Erstens muss die Elektrode ein Leiter sein, um Elektronen zum oder vom externen Stromkreis zu transportieren. Entscheidend ist, dass sie auch chemisch inert sein muss.
Sie darf nicht mit der starken Säure (typischerweise 1M HCl) reagieren oder selbst oxidiert oder reduziert werden. Platin ist ein Edelmetall, was bedeutet, dass es extrem korrosions- und auflösungsbeständig ist, was es zur perfekten stabilen, physikalischen Grundlage für die Elektrode macht.
Funktion 2: Ein überlegener Katalysator
Dies ist die wichtigste Funktion von Platin. Es beschleunigt die Wasserstoff-Redoxreaktion dramatisch.
Die Oberfläche des Platins adsorbiert sowohl die Wasserstoffgasmoleküle (H₂) als auch die Wasserstoffionen (H⁺). Stellen Sie sich die Platin-Oberfläche als Werkbank vor, die die Reaktanden an Ort und Stelle hält, was ihre Wechselwirkung erleichtert.
Durch die Adsorption von Wasserstoffgas schwächt die Platin-Oberfläche die starke kovalente H-H-Bindung, wodurch es viel einfacher wird, das Molekül in einzelne Atome zu spalten, die dann zu H⁺-Ionen oxidiert werden können. Diese katalytische Wirkung ermöglicht es der Reaktion, schnell und reversibel abzulaufen.
Die Rolle von „plattiniertem Platin“
Um diesen Effekt zu maximieren, wird die Elektrode oft mit einer Schicht aus fein verteiltem Platinpulver beschichtet, bekannt als Platinmohr. Dieser Prozess, Platinierung genannt, erhöht die effektive Oberfläche der Elektrode dramatisch und bietet viel mehr aktive Stellen für die Katalyse und stellt sicher, dass die Elektrode effizient arbeitet.
Die Kompromisse verstehen: Warum nicht andere Metalle?
Die Untersuchung, warum andere Metalle versagen, hilft zu verdeutlichen, warum Platin die definitive Wahl ist.
Das Problem mit reaktiven Metallen
Metalle wie Zink, Eisen oder Aluminium sind hochreaktiv. Würden sie in die saure Lösung der SHE gegeben, würden sie sich einfach auflösen (Zn → Zn²⁺ + 2e⁻). Dies erzeugt eine konkurrierende elektrochemische Reaktion, die die Funktion der Wasserstoffelektrode vollständig stören würde.
Das Problem mit anderen Edelmetallen
Andere inerte Metalle, wie Gold, könnten als inerter Leiter dienen. Gold ist jedoch ein deutlich schlechterer Katalysator für die Wasserstoffreaktion als Platin. Obwohl eine Goldelektrode nicht korrodieren würde, wäre die Reaktion zu langsam, um ein zuverlässiges und reproduzierbares Gleichgewichtspotential einzustellen, was den Zweck einer „Standard“-Elektrode verfehlen würde.
Die richtige Wahl für Ihr Ziel treffen
Das Verständnis der Doppelrolle von Platin ist der Schlüssel zum Erfassen der grundlegenden Prinzipien der Elektrochemie und der Referenzstandards.
- Wenn Ihr Hauptaugenmerk auf der Reaktionskinetik liegt: Denken Sie daran, dass der Hauptzweck von Platin darin besteht, als heterogener Katalysator zu wirken und die Aktivierungsenergie für die Wasserstoffreaktionen in Vorwärts- und Rückwärtsrichtung zu senken.
- Wenn Ihr Hauptaugenmerk auf dem Zellendesign liegt: Denken Sie daran, dass das Elektrodenmaterial ein inerter Leiter sein muss, der eine stabile physikalische Schnittstelle bietet, ohne an störenden Nebenreaktionen teilzunehmen.
Die Wahl von Platin ist eine bewusste technische Entscheidung, die es der Wasserstoffelektrode ermöglicht, als universeller Nullpunkt für alle elektrochemischen Messungen zu dienen.
Zusammenfassungstabelle:
| Funktion | Warum Platin ideal ist |
|---|---|
| Inerter Leiter | Widersteht Korrosion in Säure, bietet eine stabile physikalische Schnittstelle ohne störende Reaktionen. |
| Überlegener Katalysator | Adsorbiert H₂ und H⁺, schwächt H-H-Bindungen und senkt die Aktivierungsenergie für ein schnelles, reversibles Gleichgewicht. |
| Erhöhte Oberfläche | Platinierung (Platinmohr-Beschichtung) maximiert die aktiven Stellen für eine effiziente Leistung. |
Benötigen Sie zuverlässige Laborausrüstung für präzise elektrochemische Analysen? KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien und stellt sicher, dass Ihr Labor genaue und konsistente Ergebnisse erzielt. Kontaktieren Sie noch heute unsere Experten, um die perfekte Lösung für Ihre Forschungsanforderungen zu finden!
Visuelle Anleitung
Ähnliche Produkte
- Platinblechelektrode für Labor- und Industrieanwendungen
- Referenzelektrode Kalomel Silberchlorid Quecksilbersulfat für Laborzwecke
- Rotierende Platindisk-Elektrode für elektrochemische Anwendungen
- Platin-Hilfselektrode für Laboranwendungen
- Goldplattierte Elektrode
Andere fragen auch
- Was sind die Merkmale und gängigen Verwendungszwecke einer Graphitstabelektrode? Ein Leitfaden für langlebige, einfache Elektrochemie
- Gibt es einen Leistungsunterschied zwischen Kupfersulfatelektroden mit Holzstopfen und Keramikkern? Geschwindigkeit vs. Haltbarkeit erklärt
- Warum wird Bornitrid in RRDEs verwendet? Erhöhen Sie die Präzision mit überlegenem Isolier- und Schutzmaterial
- Was ist die Grundstruktur eines Elektrodenhalters und welche Funktion hat jedes Teil? Meistern Sie den Schlüssel zu zuverlässigen elektrochemischen Tests
- Welche Materialien werden zur Herstellung von Kohlefaserbürsten für elektrochemische Experimente verwendet? Maximieren Sie Ihre bioelektrochemische Leistung
- Welches Reinigungsverfahren ist für den PTFE-Elektrodenständer vor einem Experiment erforderlich? Sorgen Sie für genaue elektrochemische Ergebnisse
- Welche Eigenschaften machen Glaskohlenstoffelektroden als Anoden geeignet? Ideal für die reine Salzschmelzenelektrolyse
- Was ist die empfohlene Poliersequenz für eine Scheibenelektrode mit Kratzern? Stellen Sie die Oberfläche wieder auf einen spiegelnden Glanz her



















