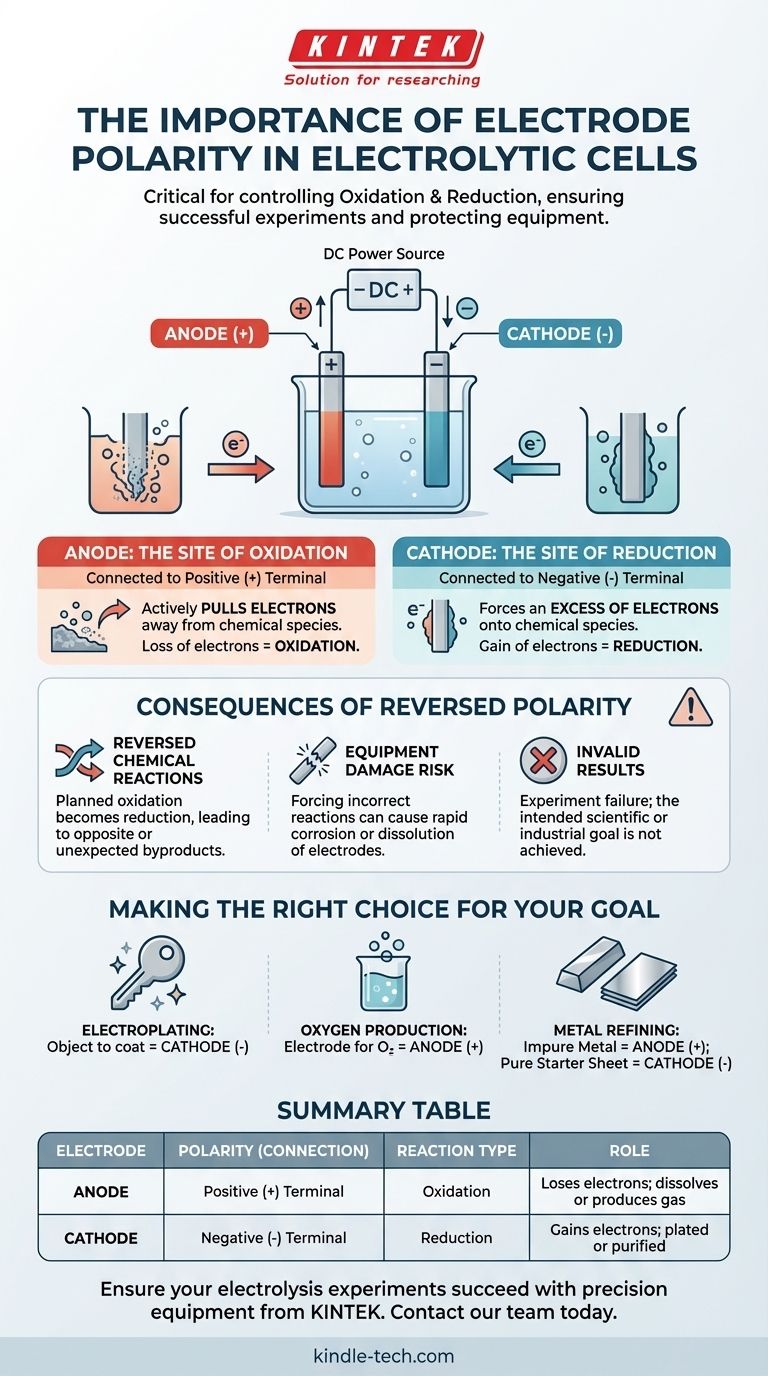
In einer Elektrolysezelle ist die korrekte Elektrodenpolarität entscheidend, da sie bestimmt, wo die grundlegenden chemischen Reaktionen der Oxidation und Reduktion stattfinden. Der Pluspol der Stromquelle definiert die Anode (den Ort der Oxidation), und der Minuspol definiert die Kathode (den Ort der Reduktion). Eine Umkehrung dieser Verbindungen würde die beabsichtigte chemische Umwandlung umkehren, was zu einem experimentellen Fehlschlag und potenziellen Geräteschäden führen würde.
Das Kernprinzip ist: Die Elektrodenpolarität ist kein willkürliches Etikett, sondern der direkte Kontrollmechanismus für Ihre chemische Reaktion. Sie bestimmt, welche Elektrode Elektronen abgibt (Oxidation) und welche sie aufnimmt (Reduktion), wodurch gesteuert wird, welche Substanzen gebildet oder verbraucht werden.

Die grundlegenden Rollen von Anode und Kathode
Um die Bedeutung der Polarität zu verstehen, müssen wir zunächst die Rollen der beiden Elektroden in einem elektrolytischen Prozess definieren. Diese Rollen werden ausschließlich durch ihre Verbindung zu einer externen Stromquelle bestimmt.
Die Anode: Der Ort der Oxidation
Die Anode ist die Elektrode, die mit dem positiven (+) Pol der Stromversorgung verbunden ist.
Diese positive Verbindung zieht aktiv Elektronen von den chemischen Spezies in der Elektrolytlösung ab, die sich in der Nähe der Anodenoberfläche befinden. Dieser erzwungene Elektronenverlust wird als Oxidation bezeichnet.
Die Kathode: Der Ort der Reduktion
Die Kathode ist die Elektrode, die mit dem negativen (-) Pol der Stromversorgung verbunden ist.
Diese negative Verbindung erzeugt einen Elektronenüberschuss auf der Kathodenoberfläche. Diese Elektronen werden dann auf die chemischen Spezies in der Lösung gezwungen, wodurch diese Elektronen aufnehmen. Dieser Prozess wird als Reduktion bezeichnet.
Die Stromversorgung: Die treibende Kraft
Im Gegensatz zu einer Standardbatterie (einer galvanischen Zelle), die Energie aus einer spontanen Reaktion erzeugt, verwendet eine Elektrolysezelle Energie, um eine nicht-spontane Reaktion anzutreiben.
Die externe Stromversorgung wirkt wie eine Pumpe für Elektronen. Sie zieht sie von der Anode ab und drückt sie zur Kathode, wodurch eine chemische Veränderung erzwungen wird, die von selbst nicht stattfinden würde.
Die Folgen einer umgekehrten Polarität verstehen
Das Anschließen der Elektroden an die falschen Pole ist kein kleiner Fehler; es verändert das gesamte Experiment grundlegend. Dies wird oft als „Umkehrung der Polarität“ bezeichnet.
Sie kehren die chemischen Reaktionen um
Wenn Sie die Verbindungen umkehren, wird die Elektrode, die Sie als Anode vorgesehen hatten, zur Kathode und umgekehrt.
Die chemische Reaktion, die Sie für die Anode geplant hatten (Oxidation), wird nicht stattfinden. Stattdessen wird dort eine Reduktionsreaktion auftreten. Das bedeutet, Ihr Experiment wird das Gegenteil Ihrer beabsichtigten Ergebnisse liefern oder völlig unerwartete Nebenprodukte erzeugen.
Sie riskieren, Ihre Ausrüstung zu beschädigen
Eine Reaktion an einem falschen Material zu erzwingen, kann zerstörerische Folgen haben. Wenn Sie beispielsweise galvanisieren, beginnt bei Umkehrung der Polarität das Objekt, das Sie beschichten wollten, sich aufzulösen.
In einigen Fällen kann der Versuch, eine Elektrode zu oxidieren, die nicht dafür ausgelegt ist, dazu führen, dass sie schnell korrodiert. Dies kann Ihre Lösung kontaminieren und die Elektrode dauerhaft beschädigen.
Ihre Ergebnisse sind ungültig
Letztendlich macht eine umgekehrte Polarität das Experiment ungültig. Wenn Sie versuchen, eine Kupferschicht auf einen Schlüssel zu plattieren, führt eine Umkehrung des Aufbaus dazu, dass die Kupferquelle mit Metall vom Schlüssel plattiert wird, wodurch der Schlüssel effektiv aufgelöst wird. Das Ergebnis ist ein Fehlschlag, das wissenschaftliche oder industrielle Ziel zu erreichen.
Die richtige Wahl für Ihr Ziel treffen
Die korrekte Zuweisung der Polarität ist entscheidend, um das chemische Ergebnis zu steuern. Bevor Sie Ihre Stromquelle anschließen, vergewissern Sie sich, welche Elektrode die Anode (+) und welche die Kathode (-) sein muss.
- Wenn Ihr Hauptaugenmerk auf dem Galvanisieren eines Objekts liegt: Das Objekt, das Sie beschichten möchten, muss die Kathode (-) sein, da hier positive Metallionen zu einer festen Metallschicht reduziert werden.
- Wenn Ihr Hauptaugenmerk auf der Erzeugung von Sauerstoffgas aus Wasser liegt: Die Elektrode, an der Sie Sauerstoff bilden möchten, muss die Anode (+) sein, da hier Wassermoleküle oxidiert werden.
- Wenn Ihr Hauptaugenmerk auf der Raffination von unreinen Metallen liegt: Der unreine Metallblock muss die Anode (+) sein, damit er oxidiert und sich in der Lösung auflösen kann, während ein reines Startblech die Kathode (-) sein muss, um das neu gereinigte Metall zu sammeln.
Die Beherrschung der Elektrodenpolarität gibt Ihnen direkte Kontrolle über die elektrochemischen Reaktionen, die Sie durchführen möchten.
Zusammenfassungstabelle:
| Elektrode | Polarität (Anschluss) | Reaktionstyp | Rolle |
|---|---|---|---|
| Anode | Positiver (+) Pol | Oxidation | Verliert Elektronen; Ziel löst sich auf oder produziert Gas (z.B. O₂) |
| Kathode | Negativer (-) Pol | Reduktion | Nimmt Elektronen auf; Ziel wird plattiert oder gereinigt |
Stellen Sie sicher, dass Ihre Elektrolyseexperimente mit Präzisionsgeräten von KINTEK erfolgreich sind.
Ob Sie Metalle raffinieren, galvanisieren oder forschen, unsere spezialisierten Laborgeräte und Verbrauchsmaterialien sind auf Genauigkeit und Langlebigkeit ausgelegt. Unsere Experten helfen Ihnen gerne bei der Auswahl der richtigen Netzteile und Elektroden, um Ihre chemischen Reaktionen perfekt zu steuern.
Riskieren Sie keine ungültigen Ergebnisse oder beschädigte Geräte – kontaktieren Sie noch heute unser Team, um Ihre spezifischen Laboranforderungen zu besprechen.
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Anpassbare PEM-Elektrolysezellen für vielfältige Forschungsanwendungen
- Anpassbare CO2-Reduktions-Flowzelle für NRR-, ORR- und CO2RR-Forschung
Andere fragen auch
- Was sind die Hauptanwendungen der Vollquarz-Elektrolysezelle? Essentiell für hochreine und optische Analysen
- Wie ist das korrekte Verfahren für die Nachbereitung und Lagerung einer Elektrolysezelle aus Quarzglas nach dem Experiment? Langlebigkeit und Reproduzierbarkeit gewährleisten
- Welche Schritte sind notwendig, um eine Elektrolysezelle aus Quarz vor einem Experiment vorzubereiten? Gewährleistung von Genauigkeit und Sicherheit
- Warum wird eine Quarz-Elektrolysezelle für Abwasser aus Acrylsäure verwendet? Gewährleistung chemischer Stabilität & Datenintegrität
- Wie sollte eine Elektrolysezelle aus reinem Quarz und ihre Komponenten für eine langfristige Nutzung gewartet werden? Ein Leitfaden zur Maximierung der Lebensdauer der Ausrüstung



















