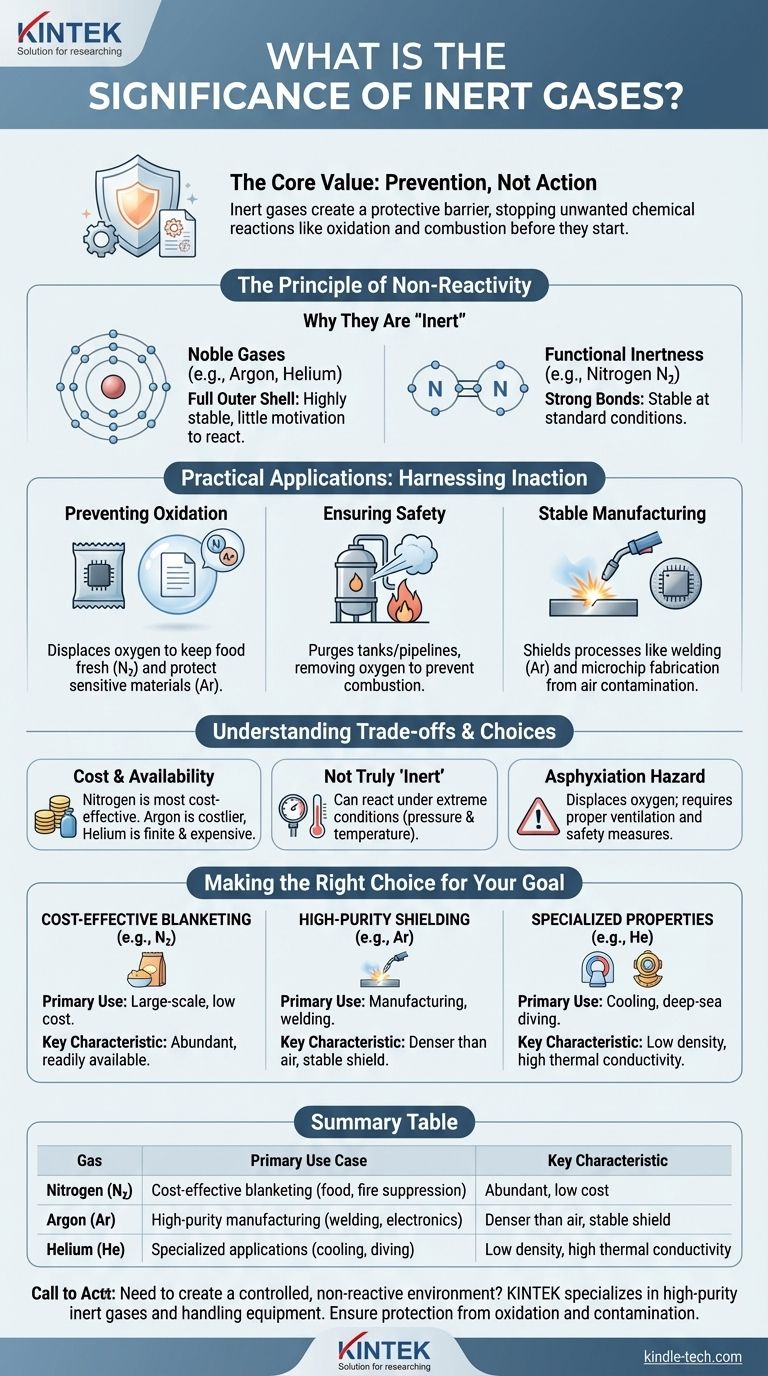
Die Bedeutung von Inertgasen liegt in ihrer definierenden Eigenschaft: einem tiefgreifenden Mangel an chemischer Reaktivität. Im Gegensatz zu reaktiven Gasen wie Sauerstoff oder Chlor bilden Inertgase nicht ohne Weiteres chemische Verbindungen mit anderen Substanzen. Diese Stabilität macht sie unschätzbar wertvoll für die Schaffung kontrollierter, nicht reaktiver Umgebungen zum Schutz empfindlicher Materialien und Prozesse.
Der Kernwert eines Inertgases liegt nicht darin, was es tut, sondern was es verhindert. Seine Nichtreaktivität ist ein mächtiges Werkzeug, das eingesetzt wird, um einen Schutzschild zu erzeugen und unerwünschte chemische Reaktionen wie Oxidation und Verbrennung zu stoppen, bevor sie beginnen können.

Das Prinzip der Nichtreaktivität
Um die Bedeutung von Inertgasen zu verstehen, müssen wir zunächst das chemische Prinzip untersuchen, das ihr Verhalten bestimmt. Es ist diese grundlegende Stabilität, die all ihren praktischen Anwendungen zugrunde liegt.
Was macht ein Gas „inert“?
Die Inertheit eines Gases wird durch seine Atomstruktur bestimmt. Die stabilsten und bekanntesten Inertgase sind die Edelgase (wie Argon, Helium und Neon), die die Gruppe 18 des Periodensystems einnehmen.
Diese Elemente besitzen eine vollständig gefüllte äußere Elektronenschale, was eine sehr stabile elektronische Konfiguration darstellt. Da diese Schale vollständig ist, haben sie nur sehr wenig „Motivation“, Elektronen mit anderen Elementen zu teilen, aufzunehmen oder abzugeben, indem sie mit ihnen reagieren.
Edelgase im Vergleich zu anderen Inertgasen
Obwohl der Begriff „Inertgas“ historisch ein Synonym für Edelgase war, ist die Definition funktional. Jedes Gas kann als inert betrachtet werden, wenn es unter einem bestimmten Satz von Bedingungen nicht reagiert.
Stickstoff (N₂) wird beispielsweise häufig als Inertgas verwendet. Obwohl es kein Edelgas ist und unter Bedingungen hoher Energie zur Reaktion gebracht werden kann, macht ihn seine starke Dreifachbindung bei Standardtemperatur und -druck sehr stabil und nicht reaktiv.
Praktische Anwendungen: Nutzung der Untätigkeit
Die Fähigkeit, reaktive Luft (die zu etwa 21 % aus Sauerstoff besteht) durch ein nicht reaktives Gas zu verdrängen, ist in zahlreichen wissenschaftlichen und industriellen Bereichen von entscheidender Bedeutung. Dieser Prozess wird oft als Begasen (Blanketing) oder Spülen (Purging) bezeichnet.
Verhinderung von Oxidation und Zersetzung
Eine der häufigsten unerwünschten Reaktionen ist die Oxidation, bei der eine Substanz mit Sauerstoff reagiert. Dies ist der Prozess, der dazu führt, dass Eisen rostet und Lebensmittel verderben.
Inertgase erzeugen eine sauerstofffreie Atmosphäre, um dies zu verhindern. Beispielsweise werden Chipstüten mit Stickstoff gefüllt, um Sauerstoff zu verdrängen und den Inhalt frisch zu halten und ein Altwerden zu verhindern. Ebenso werden empfindliche historische Dokumente oft in argon-gefüllten Behältern aufbewahrt.
Gewährleistung der Sicherheit in gefährlichen Umgebungen
In industriellen Anlagen kann ein Inertgas verwendet werden, um Tanks und Rohrleitungen zu spülen, die brennbare Flüssigkeiten oder Gase enthielten. Durch die Verdrängung des Sauerstoffs entfernt das Inertgas eine Schlüsselkomponente, die für die Verbrennung erforderlich ist, und macht die Umgebung für Wartungs- oder Inspektionsarbeiten sicher.
Schaffung stabiler Atmosphären für die Fertigung
Viele fortschrittliche Herstellungsprozesse sind sehr empfindlich gegenüber Kontamination durch die Luft.
Beim Schweißen, insbesondere beim WIG-Schweißen (Wolfram-Inertgas), schirmt ein konstanter Strom von Argon das geschmolzene Metall vor Sauerstoff und Wasserdampf ab. Ohne diesen Schutz würde die Schweißnaht spröde und schwach werden. Ein ähnliches Prinzip gilt für die Herstellung von Siliziumwafern für Mikrochips, die eine außergewöhnlich reine und nicht reaktive Umgebung erfordert.
Verständnis der Kompromisse
Obwohl sie unglaublich nützlich sind, erfordert die Auswahl und Verwendung von Inertgasen ein Verständnis ihrer Grenzen und potenziellen Gefahren.
Kosten und Verfügbarkeit
Das häufigste und kostengünstigste Gas für Inertisierungsanwendungen ist Stickstoff. Edelgase wie Argon sind teurer, und Helium ist eine endliche Ressource mit deutlich höheren Kosten, die für spezialisierte Anwendungen reserviert ist.
Nicht wirklich „inert“
Es ist eine entscheidende Unterscheidung, dass „inert“ einfach nicht reaktiv unter den gegebenen Bedingungen bedeutet. Unter extremem Druck und hoher Temperatur wurden selbst Edelgase wie Xenon und Krypton gezwungen, chemische Verbindungen einzugehen. Für fast alle praktischen Zwecke sind sie jedoch zuverlässig stabil.
Die Gefahr der Erstickung
Ein wichtiger Sicherheitsaspekt ist, dass Inertgase Erstickungsmittel (Asphyxiantien) sind. Sie sind nicht giftig, aber sie verdrängen den zum Atmen notwendigen Sauerstoff. In schlecht belüfteten oder geschlossenen Räumen kann ein Leck eines beliebigen Inertgases zu Sauerstoffmangel führen, was ohne Vorwarnung zu Bewusstlosigkeit und Tod führen kann.
Die richtige Wahl für Ihr Ziel treffen
Die Auswahl des geeigneten Inertgases hängt vollständig von den spezifischen Anforderungen der Anwendung ab, wobei Leistung, Kosten und Sicherheit abgewogen werden müssen.
- Wenn Ihr Hauptaugenmerk auf kostengünstigem Begasen liegt: Stickstoff ist aufgrund seiner geringen Kosten und hohen Verfügbarkeit fast immer die optimale Wahl für großtechnische Anwendungen wie Lebensmittelverpackungen oder Brandschutz.
- Wenn Ihr Hauptaugenmerk auf hochreiner Fertigung oder Schweißen liegt: Argon ist der Industriestandard, da es dichter als Luft ist und einen effektiveren und stabileren Schutz über einem Arbeitsbereich bietet.
- Wenn Ihr Hauptaugenmerk einzigartige physikalische Eigenschaften erfordert: Helium wird für spezielle Anwendungen wie Tauchgemische für Tiefseetaucher oder als Kühlmittel für MRT-Magnete aufgrund seiner geringen Dichte und ausgezeichneten Wärmeleitfähigkeit verwendet.
Indem Sie verstehen, dass Stabilität ein Werkzeug ist, können Sie diese nicht reaktiven Gase nutzen, um die chemische Welt um Sie herum präzise zu kontrollieren.
Zusammenfassungstabelle:
| Gas | Haupteinsatzgebiet | Schlüsselmerkmal |
|---|---|---|
| Stickstoff (N₂) | Kostengünstiges Begasen (Lebensmittelverpackung, Brandschutz) | Häufig, geringe Kosten |
| Argon (Ar) | Hochreine Fertigung (Schweißen, Elektronik) | Dichter als Luft, stabiler Schutzschild |
| Helium (He) | Spezialanwendungen (Kühlung, Tauchgemische) | Geringe Dichte, hohe Wärmeleitfähigkeit |
Müssen Sie eine kontrollierte, nicht reaktive Umgebung für Ihre Laborprozesse schaffen? KINTEK ist spezialisiert auf die Bereitstellung von hochreinen Inertgasen und der Ausrüstung, um diese sicher und effektiv zu handhaben. Ob Sie Stickstoff für kostengünstiges Begasen oder Argon für hochreines Schweißen und Fertigung benötigen, unsere Expertise stellt sicher, dass Ihre empfindlichen Materialien vor Oxidation und Kontamination geschützt sind. Kontaktieren Sie noch heute unsere Experten, um Ihre spezifische Anwendung zu besprechen und die perfekte Inertgaslösung für Ihr Labor zu finden.
Visuelle Anleitung
Ähnliche Produkte
- 1200℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- RF PECVD System Hochfrequenz-Plasma-unterstützte chemische Gasphasenabscheidung RF PECVD
- Chemische Gasphasenabscheidung CVD-Anlagenkammer-Schiebe-PECVD-Rohröfen mit Flüssiggasifikator PECVD-Maschine
- Hochleistungs-Gefriertrockner für das Labor
- Peristaltikpumpe mit variabler Drehzahl
Andere fragen auch
- Warum wird Stickstoff im Ofen verwendet? Ein kostengünstiger Schutz für Hochtemperaturprozesse
- Was ist eine Wärmebehandlung unter inerter Atmosphäre? Schützen Sie Ihre Metalle vor Oxidation & Entkohlung
- Kann Stickstoffgas erhitzt werden? Nutzen Sie die inerte Hitze für Präzision und Sicherheit
- Was ist ein inerter Zustand? Ein Leitfaden zur Vermeidung von Bränden und Explosionen
- Wie erzeugt man eine inerte Atmosphäre? Beherrschen Sie sichere, reine Prozesse durch Inertisierung
















