Inhaltsübersicht
Einführung in elektrochemische Zellen
Elektrochemische Zellen sind das Herzstück der Energiespeicherung und -umwandlung. Sie machen sich chemische Reaktionen zunutze, um Strom zu erzeugen, oder nutzen den Strom, um chemische Reaktionen anzutreiben. Diese Zellen sind wesentliche Bestandteile verschiedener elektrochemischer Systeme, darunter Batterien, Brennstoffzellen und Galvanotechnik, und sind für die Weiterentwicklung von Energietechnologien, Elektrofahrzeugen und elektrochemischer Technik unerlässlich.
Arten von elektrochemischen Zellen
Elektrochemische Zellen sind Geräte, die chemische Energie in elektrische Energie umwandeln (galvanische Zellen) oder umgekehrt (elektrolytische Zellen). Sie bestehen aus zwei Elektroden, einer Kathode und einer Anode, die in eine Elektrolytlösung getaucht sind.
Voltaische Zellen
Voltazellen, auch galvanische Zellen genannt, erzeugen Strom durch spontane chemische Reaktionen. In einer galvanischen Zelle ist die Anode die negative Elektrode, an der die Oxidation stattfindet und Elektronen freigesetzt werden. Diese Elektronen fließen durch einen externen Stromkreis zur Kathode, der positiven Elektrode, wo eine Reduktion stattfindet. Die spontane Natur der Reaktion treibt den Elektronenfluss an und erzeugt einen elektrischen Strom.
Elektrolytische Zellen
Bei elektrolytischen Zellen hingegen wird Elektrizität verwendet, um nicht spontane chemische Reaktionen anzuregen. In einer Elektrolysezelle ist die Kathode die negative Elektrode, an der die Reduktion stattfindet, und die Anode die positive Elektrode, an der die Oxidation stattfindet. Eine externe Stromquelle liefert die elektrische Energie, die notwendig ist, um die nicht spontane Reaktion in Gang zu setzen.
Hauptunterschiede
Die wichtigsten Unterschiede zwischen voltaischen und elektrolytischen Zellen sind:
- Spontaneität: Voltaische Zellen erzeugen Strom aus spontanen Reaktionen, während elektrolytische Zellen externe Energie benötigen, um nicht spontane Reaktionen anzutreiben.
- Richtung des Elektronenflusses: In voltaischen Zellen fließen die Elektronen von der Anode zur Kathode durch den äußeren Stromkreis. In elektrolytischen Zellen fließen die Elektronen von der Kathode zur Anode durch den externen Stromkreis.
- Anwendungen: Voltaische Zellen werden in Batterien, Solarzellen und anderen Geräten zur Stromerzeugung verwendet. Elektrolytische Zellen werden in der Galvanotechnik, der Metallveredelung und anderen industriellen Verfahren eingesetzt.
Bestandteile von elektrochemischen Zellen
Elektrochemische Zellen bestehen in der Regel aus den folgenden Komponenten:
- Elektroden: Die Kathode und die Anode, die aus leitfähigen Materialien (z. B. Metallen, Graphit) bestehen.
- Elektrolyt: Eine Lösung oder ein geschmolzenes Salz, das Ionen leitet und den Stromfluss zwischen den Elektroden ermöglicht.
- Abscheider: Eine poröse Barriere, die verhindert, dass sich die Elektroden direkt berühren, aber die Ionen durchlässt.
Zusätzliche Informationen
- Das Zellpotenzial bzw. die Spannung einer elektrochemischen Zelle ist ein Maß für die Antriebskraft der Reaktion. In galvanischen Zellen ist das Zellpotenzial positiv, was auf eine spontane Reaktion hinweist. In elektrolytischen Zellen ist das Zellpotenzial negativ, was auf eine nicht spontane Reaktion hinweist.
- Der Wirkungsgrad einer elektrochemischen Zelle wird von Faktoren wie den Elektrodenmaterialien, der Elektrolytkonzentration und der Temperatur bestimmt.
- Elektrochemische Zellen spielen eine entscheidende Rolle in verschiedenen technologischen Anwendungen, darunter Energiespeicherung, chemische Synthese und Umweltsanierung.
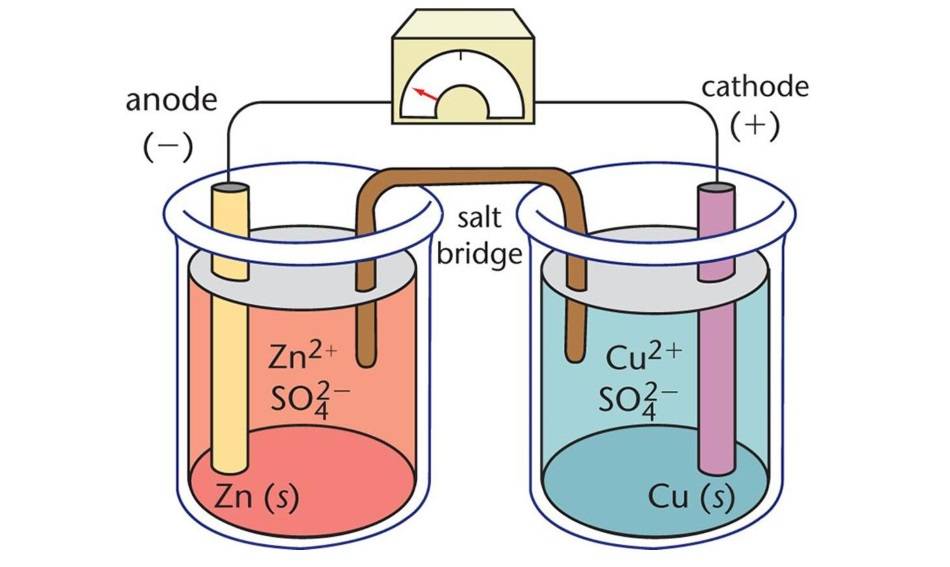
Bestandteile von elektrolytischen Zellen
Elektrolytische Zellen, eine Art elektrochemische Zelle, sind Geräte, die elektrische Energie nutzen, um nicht spontane chemische Reaktionen auszulösen. Sie bestehen aus drei Hauptkomponenten: der Anode, der Kathode und dem Elektrolyten.
Anode
Die Anode dient als negative Elektrode in einer elektrolytischen Zelle. Während der elektrochemischen Reaktion gibt die Anode Elektronen an den äußeren Kreislauf ab und wird oxidiert. Mit anderen Worten, an der Anode finden der Elektronenverlust und die Oxidation statt.
Kathode
Die Kathode hingegen ist die positive Elektrode. Sie nimmt Elektronen aus dem äußeren Stromkreis auf und wird während der elektrochemischen Reaktion reduziert. Die Kathode ist also der Ort, an dem die Elektronenaufnahme und die Reduktion stattfinden.
Elektrolyt
Der Elektrolyt ist eine Substanz, die mobile Ionen enthält, wenn sie in einem Lösungsmittel gelöst oder geschmolzen ist. In elektrolytischen Zellen stellt der Elektrolyt ein Medium für den Ionenfluss zwischen Anode und Kathode dar, wodurch der elektrische Stromkreis geschlossen wird. Übliche Elektrolyte sind wässrige Salzlösungen und geschmolzene Salze.
Hauptunterschiede zu galvanischen Zellen
Elektrolytische Zellen unterscheiden sich von galvanischen Zellen in mehreren wichtigen Aspekten:
- Zellreaktionen: Elektrolytische Zellen benötigen eine externe Quelle elektrischer Energie, um nicht spontane Reaktionen auszulösen, während galvanische Zellen elektrische Energie aus spontanen Reaktionen erzeugen.
- Energiefluss: Elektrolytische Zellen verbrauchen elektrische Energie, um nicht-spontane Reaktionen zu fördern, während galvanische Zellen chemische Energie in elektrische Energie umwandeln.
- Elektrodenladungen: In elektrolytischen Zellen ist die Anode negativ und die Kathode positiv, während in galvanischen Zellen die Anode positiv und die Kathode negativ ist.
Funktionsweise einer elektrolytischen Zelle
Der Betrieb einer elektrolytischen Zelle umfasst die folgenden Schritte:
- Eine externe Stromquelle (z. B. eine Batterie) wird an die Elektroden der Elektrolysezelle angeschlossen.
- Die Stromquelle liefert elektrische Energie, die die nicht spontane Reaktion antreibt.
- An der Anode findet eine Oxidation statt, bei der Elektronen in den externen Stromkreis freigesetzt werden.
- Die Elektronen fließen durch den äußeren Stromkreis zur Kathode.
- An der Kathode findet eine Reduktion statt, bei der Elektronen aus dem externen Kreislauf aufgenommen werden.
- Die Ionen im Elektrolyten wandern, um die elektrische Neutralität aufrechtzuerhalten und den Stromkreis zu schließen.
Anwendungen von elektrolytischen Zellen
Elektrolysezellen haben zahlreiche praktische Anwendungen, darunter:
- Galvanik: Aufbringen einer dünnen Metallschicht auf eine Oberfläche zu Dekorations- oder Schutzzwecken.
- Elektrolyse von Wasser: Erzeugung von Wasserstoff und Sauerstoff aus Wasser, das in Brennstoffzellen und anderen Anwendungen eingesetzt wird.
- Herstellung von Chemikalien: Synthese verschiedener Chemikalien, z. B. Chlor, Natriumhydroxid und Aluminium.
- Raffinieren von Metallen: Reinigen von Metallen durch Entfernen von Verunreinigungen mittels Elektrolyse.

Elektrodenpotentiale und Redoxreaktionen
Elektrochemische Zellen ermöglichen Oxidations-Reduktions-Reaktionen (Redox). Es gibt zwei Arten von Zellen: galvanische (voltaische) Zellen, in denen spontane Reaktionen ablaufen, und elektrolytische Zellen, in denen nicht-spontane Reaktionen ablaufen.
In elektrochemischen Zellen findet die Oxidationsreaktion an der Anode (negativer Pol) statt, während die Reduktionsreaktion an der Kathode (positiver Pol) abläuft. In elektrolytischen Zellen zieht die Anode Anionen an, wodurch sie positiv wird, während in galvanischen Zellen die Anode aufgrund der Freisetzung von Elektronen aus der spontanen Oxidationsreaktion negativ ist.
Die Richtung des Elektronenflusses und die Spontaneität der Redoxreaktionen werden durch das Elektrodenpotenzial bestimmt, d. h. den Potenzialunterschied zwischen den Elektroden. Als Referenzpunkt dient die Standard-Wasserstoffelektrode (SHE) mit einer Spannung von 0 Volt.
Das Zellpotenzial, das anhand der Elektrodenpotenziale vorhergesagt werden kann, liefert einen Schätzwert für das gemessene Potenzial. Zur Berechnung des Zellpotenzials müssen die Gleichungen der Halbzellenreaktion ausgeglichen und die Spannungsdifferenz zwischen den Elektrodenpotenzialen bestimmt werden.
Die Kathode und die Anode spielen in elektrochemischen Zellen unterschiedliche Rollen:
Kathode:
- Positives Vorzeichen aufgrund des Elektronenverbrauchs
- Reduktionsreaktion findet statt
- Elektronen treten ein
Anode:
- Negatives Vorzeichen durch Elektronenabgabe
- Oxidationsreaktion läuft ab
- Elektronen treten aus
Bei der Bezeichnung einer elektrochemischen Zelle steht die Kathode auf der rechten Seite, die Anode auf der linken Seite.
Anwendungen von elektrochemischen Zellen
Elektrochemische Zellen haben ein breites Anwendungsspektrum in verschiedenen Bereichen, darunter Energiespeicherung, Energieumwandlung und industrielle Prozesse.
Elektroplattieren
Bei der Galvanisierung wird mithilfe elektrochemischer Zellen eine dünne Metallschicht auf die Oberfläche eines anderen Metalls aufgebracht. Durch dieses Verfahren werden die Eigenschaften des Grundmetalls verbessert, z. B. Korrosionsbeständigkeit, Abriebfestigkeit und Verschleißfestigkeit. Die Galvanotechnik wird in vielen Industriezweigen eingesetzt, z. B. in der Automobil-, Elektronik- und Schmuckindustrie, und zwar sowohl für funktionale als auch für ästhetische Zwecke.
Batterien
Elektrochemische Zellen bilden die Grundlage von Batterien, die wesentliche Bestandteile zahlreicher elektronischer Geräte und Apparate sind. Batterien speichern chemische Energie und wandeln sie bei Bedarf in elektrische Energie um. Sie sind unerlässlich für die Stromversorgung tragbarer Geräte wie Smartphones, Laptops und Elektrofahrzeuge.
Elektrogewinnung und Elektroraffination
Elektrochemische Zellen werden bei der elektrolytischen Gewinnung und der Elektroraffination eingesetzt, um Metalle zu gewinnen und zu reinigen. Bei der elektrolytischen Gewinnung werden Metalle durch Elektrolyse aus Erzen oder anderen Quellen gewonnen, während bei der Elektroraffination die Metalle durch Entfernung von Verunreinigungen weiter gereinigt werden. Diese Verfahren sind entscheidend für die Gewinnung hochreiner Metalle wie Kupfer, Zink und Aluminium, die für verschiedene industrielle Anwendungen unerlässlich sind.
Andere Anwendungen
Elektrochemische Zellen finden auch in verschiedenen anderen Bereichen Anwendung:
- Wasseraufbereitung: Sie werden in der Wasserelektrolyse eingesetzt, um Wasserstoff- und Sauerstoffgas zu erzeugen, die für Brennstoffzellen und andere industrielle Prozesse unerlässlich sind.
- Brennstoffzellen: Elektrochemische Zellen sind die Kernbestandteile von Brennstoffzellen, die durch elektrochemische Reaktionen mit Wasserstoff und Sauerstoff Strom erzeugen.
- Chemische Synthese: Elektrochemische Zellen können in chemischen Syntheseprozessen zur Herstellung verschiedener Chemikalien und Materialien eingesetzt werden.
- Sensoren und Biosensoren: Elektrochemische Zellen werden in Sensoren und Biosensoren eingesetzt, um bestimmte Substanzen auf der Grundlage ihrer elektrochemischen Eigenschaften zu erkennen und zu analysieren.

Schlussfolgerung
Elektrochemische Zellenmit ihrer Fähigkeit, chemische Energie in elektrische Energie umzuwandeln und umgekehrt, sind unverzichtbare Werkzeuge in verschiedenen Bereichen. Sie dienen als Grundlage für die Energiespeicherung und -umwandlung sowie für zahlreiche industrielle Prozesse. Von Batterien, die unsere Geräte antreiben, bis hin zu Brennstoffzellen, die saubere Energie erzeugen, prägen elektrochemische Zellen den technologischen Fortschritt. Das Verständnis ihrer Prinzipien und Anwendungen ist von entscheidender Bedeutung für weitere Innovationen in den Bereichen Energietechnologien, nachhaltige Lösungen und elektrochemische Technik.
Ähnliche Produkte
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
- Elektrochemische Elektrolysezelle mit Gasdiffusion und Flüssigkeitsströmungsreaktionszelle
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Optische Elektrolysezelle mit Seitenfenster
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
Ähnliche Artikel
- Anwendungen der H-Typ-Elektrolysezelle in der Metallextraktion
- Anwendungen von Elektrolysezellen in der Reinigung und Galvanisierung
- Verständnis von Elektrolysezellen und ihrer Rolle bei der Kupferreinigung und Galvanisierung
- Die unsichtbare Variable: Beherrschen Sie die Inspektion von Elektrolysezellen
- Herausforderungen mit dem Betrieb von H-Typ-Elektrolysezellen meistern




















