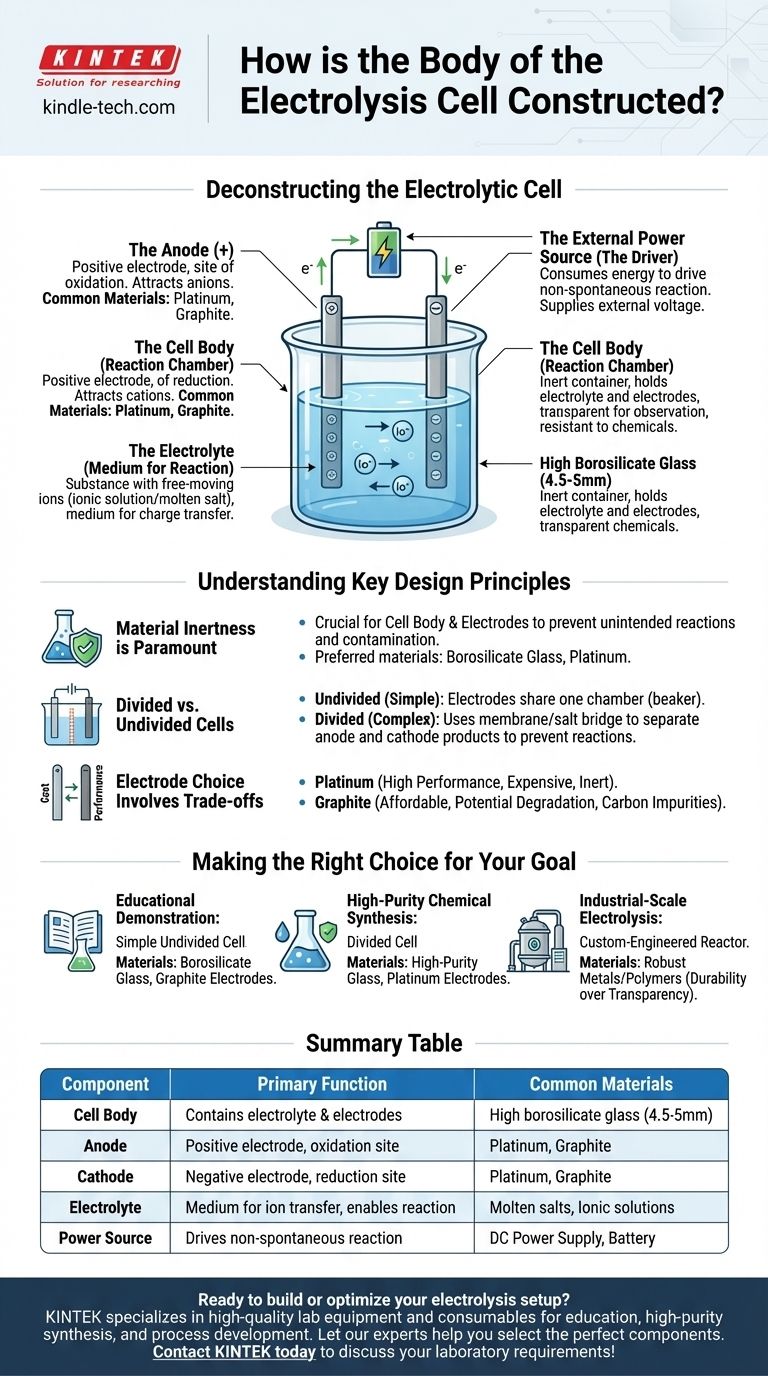
Für Laboranwendungen wird der Körper einer Elektrolysezelle typischerweise aus hochreinem Borosilikatglas gefertigt, oft mit einer Wandstärke von etwa 4,5 bis 5 mm. Dieses Material wird aufgrund seiner chemischen Inertheit und thermischen Beständigkeit gewählt. Der physische Behälter ist jedoch nur ein Teil eines größeren Systems, das darauf ausgelegt ist, eine chemische Reaktion mittels Elektrizität anzutreiben.
Der Zellkörper ist lediglich ein inerter Behälter. Die wahre Funktion einer Elektrolysezelle wird durch ihre drei zentralen internen Komponenten definiert: zwei Elektroden (Anode und Kathode), einen Elektrolyten mit mobilen Ionen und eine externe Stromquelle, um die Reaktion anzutreiben.

Die Elektrolysezelle im Detail
Um den Aufbau der Zelle zu verstehen, muss man über das physische Gefäß hinausblicken und die funktionalen Komponenten analysieren, die es beherbergt. Eine Elektrolysezelle ist ein vollständiges System, in dem jeder Teil eine entscheidende Rolle im Prozess der Elektrolyse spielt.
Der Zellkörper (Die Reaktionskammer)
Die Hauptfunktion des Körpers besteht darin, den Elektrolyten zu enthalten und die Elektroden an Ort und Stelle zu halten, ohne die chemische Reaktion zu beeinträchtigen.
Hochreines Borosilikatglas ist ein gängiges Material, da es transparent ist, Beobachtungen ermöglicht und sehr korrosionsbeständig gegenüber den oft aggressiven Chemikalien ist, die als Elektrolyte verwendet werden. Für spezielle Anwendungen können auch andere inerte Materialien wie bestimmte Polymere verwendet werden.
Die Elektroden (Anode und Kathode)
Elektroden sind die Leiter, die elektrische Energie in das System einführen. Eine Elektrolysezelle hat immer zwei.
- Die Anode ist die positive Elektrode. Sie zieht negativ geladene Ionen (Anionen) an und ist der Ort, an dem Oxidation stattfindet.
- Die Kathode ist die negative Elektrode. Sie zieht positiv geladene Ionen (Kationen) an und ist der Ort, an dem Reduktion stattfindet.
Diese werden typischerweise aus inerten Materialien wie Platin oder Graphit hergestellt, die Elektrizität gut leiten, aber selbst nicht leicht an der chemischen Reaktion teilnehmen.
Der Elektrolyt (Das Medium für die Reaktion)
Der Elektrolyt ist die Substanz, die frei bewegliche Ionen enthält und den Zellkörper füllt. Er ist das Medium, durch das Ladung zwischen den Elektroden übertragen wird.
Elektrolyte können eine ionische Verbindung sein, die in einem Lösungsmittel gelöst ist (wie Salz in Wasser), oder eine geschmolzene ionische Verbindung (wie geschmolzenes Natriumchlorid). Die spezifischen Ionen innerhalb des Elektrolyten sind diejenigen, die während der Elektrolyse oxidiert oder reduziert werden.
Die externe Stromquelle (Der Treiber)
Im Gegensatz zu einer Batterie, die Energie erzeugt, verbraucht eine Elektrolysezelle Energie, um eine nicht-spontane Reaktion zu erzwingen.
Diese Energie wird von einer externen Stromquelle, wie einer Batterie oder einem Gleichstromnetzteil, geliefert, die mit Anode und Kathode verbunden ist. Diese externe Spannung ist es, die Elektronen durch den Stromkreis treibt und die Ionen zu ihren jeweiligen Elektroden lenkt.
Grundlegende Konstruktionsprinzipien verstehen
Die Konstruktion einer Elektrolysezelle wird von grundlegenden Prinzipien geleitet, die ihre ordnungsgemäße Funktion gewährleisten. Ein Missverständnis dieser kann zu fehlgeschlagenen Experimenten oder ineffizienten Prozessen führen.
Materialinertheit ist von größter Bedeutung
Das wichtigste Prinzip für den Zellkörper und die Elektroden ist die chemische Inertheit. Der Behälter und die elektrischen Leiter dürfen nicht mit dem Elektrolyten reagieren. Jede unbeabsichtigte Reaktion kann die Produkte verunreinigen und den gewünschten elektrochemischen Prozess stören. Aus diesem Grund werden spezielle Materialien wie Borosilikatglas und Platin gegenüber Standardglas oder reaktiven Metallen bevorzugt.
Geteilte vs. ungeteilte Zellen
Das einfachste Zelldesign ist eine „ungeteilte“ Zelle, bei der beide Elektroden einen gemeinsamen Elektrolyten in einer einzigen Kammer teilen, wie in einem Becherglas.
Manchmal können jedoch die an Anode und Kathode gebildeten Produkte miteinander reagieren. In diesen Fällen wird eine „geteilte“ Zelle verwendet. Dieses Design umfasst eine poröse Membran oder eine Salzbrücke, um die Zelle in zwei separate Halbzellen zu unterteilen, wodurch die Produkte isoliert bleiben, während Ionen weiterhin zwischen den Kompartimenten fließen können.
Die Elektrodenwahl beinhaltet Kompromisse
Obwohl beide gängig sind, beinhaltet die Wahl zwischen Platin- und Graphitelektroden einen klassischen Kompromiss zwischen Kosten und Leistung.
Platin ist extrem inert und effizient, aber sehr teuer. Graphit ist ein wesentlich günstigerer Leiter, kann aber unter bestimmten Bedingungen, insbesondere bei hohen Spannungen oder mit spezifischen Elektrolyten, degradieren oder reagieren und potenziell Kohlenstoffverunreinigungen in das System einbringen.
Die richtige Wahl für Ihr Ziel treffen
Die optimale Konstruktion einer Elektrolysezelle hängt vollständig von ihrem Verwendungszweck ab.
- Wenn Ihr Hauptaugenmerk auf einer Lehrdemonstration liegt: Ein einfaches, ungeteiltes Becherglas aus Borosilikatglas mit preiswerten Graphitelektroden ist völlig ausreichend und kostengünstig.
- Wenn Ihr Hauptaugenmerk auf der hochreinen chemischen Synthese liegt: Eine geteilte Zelle aus hochreinem Glas mit stabilen, inerten Platinelektroden ist unerlässlich, um Produktverunreinigungen und Nebenreaktionen zu verhindern.
- Wenn Ihr Hauptaugenmerk auf der Elektrolyse im industriellen Maßstab liegt: Die Zelle wird ein hochspezialisierter, maßgeschneiderter Reaktor sein, der oft aus robusten Metallen oder Polymeren gebaut wird, die auf Haltbarkeit, Effizienz und Dauerbetrieb statt auf Transparenz ausgelegt sind.
Das Verständnis dieser Kernkomponenten und ihrer Funktionen ermöglicht es Ihnen, eine Zelle auszuwählen oder zu entwerfen, die genau Ihren Zielen entspricht.
Zusammenfassungstabelle:
| Komponente | Primäre Funktion | Gängige Materialien |
|---|---|---|
| Zellkörper | Enthält den Elektrolyten und die Elektroden | Hochreines Borosilikatglas (4,5-5mm) |
| Anode | Positive Elektrode; Ort der Oxidation | Platin, Graphit |
| Kathode | Negative Elektrode; Ort der Reduktion | Platin, Graphit |
| Elektrolyt | Medium für den Ionentransfer; ermöglicht die Reaktion | Geschmolzene Salze, Ionische Lösungen |
| Stromquelle | Treibt die nicht-spontane Reaktion an | Gleichstromnetzteil, Batterie |
Bereit, Ihre Elektrolyseanlage zu bauen oder zu optimieren? Die richtige Zellkonstruktion ist entscheidend für den Erfolg Ihres Labors, sei es für die Ausbildung, die hochreine Synthese oder die Prozessentwicklung. KINTEK ist spezialisiert auf die Bereitstellung der hochwertigen Laborausrüstung und Verbrauchsmaterialien, die Sie benötigen – von langlebigen Borosilikatglasgeräten bis hin zu inerten Platin- und Graphitelektroden. Lassen Sie sich von unseren Experten bei der Auswahl der perfekten Komponenten für Ihre spezifische Anwendung helfen. Kontaktieren Sie KINTEK noch heute, um Ihre Laboranforderungen zu besprechen!
Visuelle Anleitung
Ähnliche Produkte
- Doppelschichtige Fünfloch-Wasserbad-Elektrolysezelle
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Anpassbare PEM-Elektrolysezellen für vielfältige Forschungsanwendungen
- Doppelte Wasserbad-Elektrolysezelle
Andere fragen auch
- Was sind die typischen Volumina und Öffnungskonfigurationen für eine doppelwandige Wasserbad-Elektrolysezelle? Optimieren Sie Ihr elektrochemisches Setup
- Welches typische experimentelle System wird mit einer doppelwandigen Wasserbad-Elektrolysezelle verwendet? Präzise elektrochemische Kontrolle erreichen
- Wie ist die Gesamtstruktur der optischen H-Typ-Doppelschicht-Wasserbad-Elektrolysezelle aufgebaut? Präzisionsdesign für kontrollierte Experimente
- Was sind die Hauptmerkmale der Fünf-Port-Wasserbad-Elektrolysezelle? Präzisionskontrolle für elektrochemische Experimente
- Wie lauten die Verfahren nach der Verwendung einer doppelschichtigen Wasserbad-Elektrolysezelle? Gewährleistung der Langlebigkeit der Geräte und der Daten-Genauigkeit



















