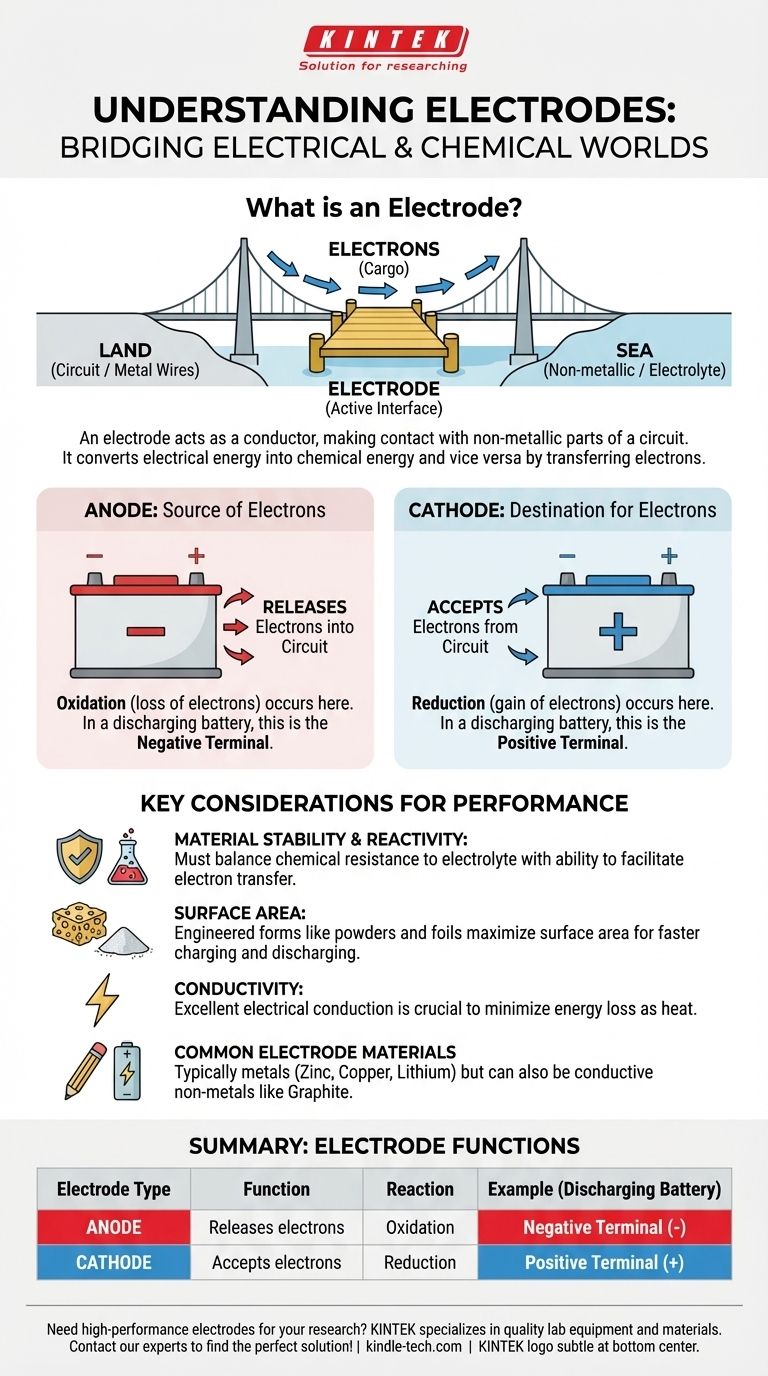
Im Kern ist eine Elektrode eine Brücke. Sie ist ein elektrischer Leiter, der verwendet wird, um Kontakt mit einem nichtmetallischen Teil eines Stromkreises herzustellen und so den Stromfluss zwischen ihnen zu ermöglichen. Die positiven und negativen Pole jeder Batterie sind beispielsweise die externen Anschlusspunkte für zwei interne Elektroden, die in eine chemische Lösung eingetaucht sind.
Die wesentliche Aufgabe einer Elektrode besteht nicht nur darin, Elektrizität zu leiten, sondern als physikalische Schnittstelle zu dienen, an der elektrische Energie durch die Abgabe oder Aufnahme von Elektronen in chemische Energie (und umgekehrt) umgewandelt wird.

Die grundlegende Rolle einer Elektrode
Die Hauptfunktion einer Elektrode besteht darin, ein grundlegendes Problem zu lösen: Wie lässt man Strom durch ein Material fließen, das kein einfacher Metalldraht ist.
Brücke zwischen zwei Welten
Stellen Sie sich eine Elektrode als einen spezialisierten Anlegesteg vor. Die Metalldrähte in einem Stromkreis sind das „Land“, und eine nichtmetallische Substanz wie ein flüssiger Elektrolyt in einer Batterie ist das „Meer“. Die Elektrode ist der Anlegesteg, an dem Elektronen (die „Fracht“) zwischen Land und Meer übertragen werden.
Zu diesen nichtmetallischen Substanzen können Elektrolyte (in Batterien), Halbleiter (in Transistoren), Gase (in Leuchtreklamen) oder sogar ein Vakuum (in alten Vakuumröhren) gehören.
Ein Ort für chemische Reaktionen
In vielen Anwendungen, insbesondere in Batterien, sind Elektroden keine passiven Leiter. Sie sind aktive Teilnehmer an chemischen Reaktionen.
Auf der Oberfläche einer Elektrode finden Oxidation (der Verlust von Elektronen) oder Reduktion (der Gewinn von Elektronen) statt. Diese kontrollierte chemische Reaktion ermöglicht es einer Batterie, Energie zu speichern und freizusetzen.
Häufige Elektrodenmaterialien
Obwohl sie typischerweise aus Metallen wie Zink, Kupfer oder Lithium bestehen, sind Elektroden nicht ausschließlich metallisch. Jeder gute elektrische Leiter kann dienen.
Zum Beispiel ist Graphit (eine Form von Kohlenstoff) ein sehr verbreitetes Elektrodenmaterial, das in Batterien und industrieller Elektrolyse verwendet wird, da es ein ausgezeichneter Leiter und chemisch stabil ist.
Anoden und Kathoden: Die beiden Schlüsseltypen
In jedem System mit zwei Elektroden werden diese je nach der chemischen Reaktion, die auf ihrer Oberfläche stattfindet, spezifische Namen erhalten. Diese Bezeichnungen sind entscheidend für das Verständnis der Funktionsweise elektrochemischer Zellen.
Die Anode: Die Quelle der Elektronen
Die Anode wird als die Elektrode definiert, an der die Oxidation stattfindet. Einfach ausgedrückt ist es die Elektrode, die Elektronen in den Stromkreis abgibt.
In einer Batterie, die ein Gerät mit Strom versorgt (Entladung), ist die Anode der negative Pol.
Die Kathode: Das Ziel für Elektronen
Die Kathode ist die Elektrode, an der die Reduktion stattfindet. Es ist die Elektrode, die Elektronen aus dem Stromkreis aufnimmt.
Beim Entladen einer Batterie ist die Kathode der positive Pol.
Verständnis der Schlüsselüberlegungen
Die Wahl des Elektrodenmaterials ist eine kritische Designentscheidung, bei der mehrere konkurrierende Faktoren abgewogen werden müssen.
Materialstabilität und Reaktivität
Eine Elektrode muss chemisch stabil genug sein, um ihrer Umgebung, die oft ein korrosiver Elektrolyt ist, standzuhalten. Wenn sie zu schnell degradiert, fällt das Gerät aus.
Gleichzeitig muss sie reaktiv genug sein, um den gewünschten Elektronentransfer zu ermöglichen. Dieses Gleichgewicht zwischen Stabilität und Reaktivität ist der Schlüssel zur Leistung.
Oberfläche und Leistung
Die Geschwindigkeit einer chemischen Reaktion wird oft durch die verfügbare Oberfläche begrenzt. Aus diesem Grund sind viele moderne Elektroden keine massiven Metallblöcke.
Stattdessen werden sie aus Pulvern, Folien oder Schäumen konstruiert, um eine massive Oberfläche auf kleinem Raum zu erzeugen. Dies erhöht die Ausgangsleistung des Geräts und ermöglicht ein schnelleres Laden und Entladen.
Leitfähigkeit ist nicht verhandelbar
Vor allem muss das Material ein ausgezeichneter elektrischer Leiter sein. Jeder Widerstand in der Elektrode selbst verschwendet Energie als Wärme und verringert die Gesamteffizienz des Geräts.
Die richtige Wahl für Ihr Ziel treffen
Die Begriffe Anode und Kathode sind an die Richtung des Elektronenflusses gebunden, daher hängt ihre physische Position vom Kontext ab.
- Wenn Sie eine Batterie betrachten: Der Pluspol (+) ist der externe Anschluss für die Kathode, und der Minuspol (-) ist der Anschluss für die Anode.
- Wenn Sie Elektrolyse untersuchen (Verwendung von Elektrizität zur Durchführung einer Reaktion): Die an die positive Seite der Stromquelle angeschlossene Elektrode ist die Anode, und die an die negative Seite angeschlossene Elektrode ist die Kathode.
- Wenn Sie mit einem Halbleiterbauelement arbeiten: Die Elektroden sind die benannten Metallkontakte (z. B. Source, Drain, Gate), die es Ihnen ermöglichen, den Stromfluss durch das Silizium zu steuern.
Das Verständnis der Rolle einer Elektrode ist der erste Schritt, um zu beherrschen, wie moderne Technologie elektrische Energie speichert, freisetzt und steuert.
Zusammenfassungstabelle:
| Elektrodentyp | Funktion | Reaktion | Beispiel (Entladende Batterie) |
|---|---|---|---|
| Anode | Gibt Elektronen in den Stromkreis ab | Oxidation (Elektronenverlust) | Negativer Pol (-) |
| Kathode | Nimmt Elektronen aus dem Stromkreis auf | Reduktion (Elektronengewinn) | Positiver Pol (+) |
Benötigen Sie Hochleistungselektroden oder Laborgeräte für Ihre Forschung? Die Wahl des richtigen Elektrodenmaterials ist entscheidend für die Effizienz und Langlebigkeit Ihrer Geräte. KINTEK ist spezialisiert auf die Bereitstellung hochwertiger Laborgeräte und Verbrauchsmaterialien, einschließlich stabiler und leitfähiger Elektrodenmaterialien, um Ihre Innovationen voranzutreiben. Kontaktieren Sie noch heute unsere Experten, um Ihre spezifische Anwendung zu besprechen und die perfekte Lösung für Ihre Laboranforderungen zu finden!
Visuelle Anleitung
Ähnliche Produkte
- Leitfähiges Kohlenstofftuch, Kohlenstoffpapier, Kohlenstofffilz für Elektroden und Batterien
- Elektrodenpolier-Material für elektrochemische Experimente
- Leitfähige Bornitrid-BN-Keramiken-Verbundwerkstoffe für fortschrittliche Anwendungen
- Kundenspezifischer PTFE-Teflon-Teilehersteller für PTFE-Behälter
- Laborhydraulikpresse Labor-Pelletpresse für Knopfzellenbatterien
Andere fragen auch
- Wie sollten Elektroden vor Beginn eines Experiments vorbereitet werden? Eine Schritt-für-Schritt-Anleitung für zuverlässige Ergebnisse
- Was sind die Vorteile der Verwendung einer Platinelektrode als Gegenelektrode? Gewährleistung hochpräziser Forschungsdaten
- Welche Temperaturgrenzwerte gelten für eine Platinelektrode? Gewährleistung genauer Messungen & Langlebigkeit
- Wie hoch ist die erwartete Lebensdauer einer Platin-Draht-/Stabelektrode? Maximieren Sie die Leistung durch richtige Pflege
- Warum ist eine Ag/AgCl-Referenzelektrode in der Dünnschicht-Voltammetrie wichtig? Präzision bei elektrochemischen Tests erreichen
- Warum ist Silber/Silberchlorid als Elektrode am nützlichsten? Erreichen Sie stabile und genaue Spannungsmessungen
- Welche Elektrodentypen sind mit Dünnschicht-Spektroelektrochemie-Zellen kompatibel? Optimieren Sie Ihre Hardware-Passform
- Was ist ein kritischer Gesichtspunkt hinsichtlich der Elektrodenpolarität? Vermeiden Sie einen katastrophalen Systemausfall



















