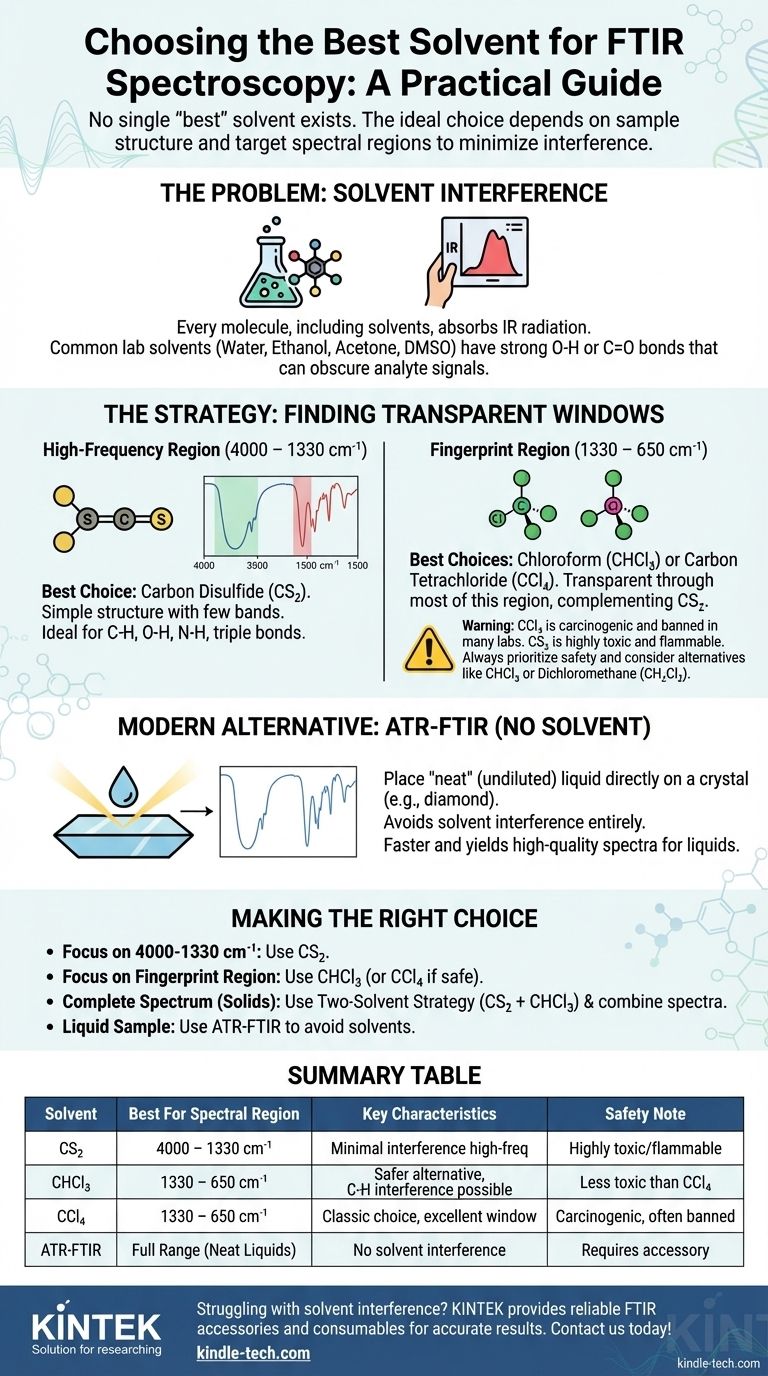
Kurz gesagt, es gibt nicht das eine „beste“ Lösungsmittel für die FTIR-Spektroskopie. Die ideale Wahl hängt vollständig von der chemischen Struktur Ihrer Probe und den spezifischen Spektralbereichen ab, die Sie analysieren möchten. Der gängigste und effektivste Ansatz beinhaltet die Verwendung von Lösungsmitteln wie Schwefelkohlenstoff (CS₂) und Tetrachlorkohlenstoff (CCl₄) oder Chloroform (CHCl₃), da deren eigene Absorptionsbanden einfach und vorhersagbar sind und große „Fenster“ der Transparenz bieten, um die interessierende Verbindung zu betrachten.
Die Kernherausforderung bei der Lösungsmittelauswahl in der FTIR besteht darin, dass jedes Lösungsmittel Infrarotstrahlung in gewissem Maße absorbiert. Die Strategie besteht daher nicht darin, ein perfekt „unsichtbares“ Lösungsmittel zu finden, sondern eines auszuwählen, dessen Absorptionsbanden nicht mit den wichtigen Schwingungsbanden Ihres Analyten überlappen.

Das Problem: Lösungsmittelinterferenzen
Jedes Molekül, einschließlich eines Lösungsmittelmoleküls, besteht aus chemischen Bindungen, die bei Bestrahlung mit Infrarotstrahlung schwingen. Diese Schwingungen verursachen Absorptionsbanden in einem IR-Spektrum.
Das Ideal vs. Die Realität
Ein ideales Lösungsmittel wäre „IR-transparent“, was bedeutet, dass es keine Schwingungen aufweist, die Strahlung im mittleren IR-Bereich (4000–400 cm⁻¹) absorbieren. Ein solches Lösungsmittel existiert nicht.
Das Ziel ist es, ein Lösungsmittel auszuwählen, das so wenig wie möglich stört. Dies bedeutet typischerweise ein kleines, einfaches Molekül mit wenigen oder keinen Bindungen, die gängigen funktionellen Gruppen wie O-H, N-H oder C=O entsprechen.
Warum gängige Laborlösungsmittel versagen
Lösungsmittel wie Wasser, Ethanol, Aceton und DMSO sind für die Transmissions-FTIR im Allgemeinen ungeeignet. Sie enthalten O-H- oder C=O-Bindungen, die sehr stark absorbieren und breite, intensive Peaks erzeugen, die das gesamte Spektrum der gelösten Probe leicht verdecken können.
Ein praktischer Leitfaden zu gängigen FTIR-Lösungsmitteln
Die beste Vorgehensweise beinhaltet oft die Verwendung eines Lösungsmittelpaares, um ein vollständiges Spektrum zusammenzusetzen. Ein Lösungsmittel wird für den hochfrequenten Bereich und ein anderes für den niederfrequenten „Fingerprint“-Bereich verwendet.
Für den hochfrequenten Bereich (4000 – 1330 cm⁻¹)
Schwefelkohlenstoff (CS₂) ist die erste Wahl für diesen Bereich.
Seine einfache, lineare Struktur (S=C=S) bedeutet, dass es nur wenige Absorptionsbanden aufweist. Es ist weitgehend transparent dort, wo C-H-, O-H-, N-H- und Dreifachbindungsstreckschwingungen auftreten, was es ideal für die Analyse dieser kritischen funktionellen Gruppen macht. Seine Hauptinterferenz ist eine starke Bande um 1535–1485 cm⁻¹.
Für den Fingerprint-Bereich (1330 – 400 cm⁻¹)
Tetrachlorkohlenstoff (CCl₄) ist die klassische Wahl für diesen Bereich.
Es ist ein einfaches, symmetrisches Molekül, das im größten Teil des mittleren IR-Bereichs transparent ist, aber sehr starke Absorptionen unterhalb von ca. 800 cm⁻¹ aufweist. Dies macht es zur perfekten Ergänzung zu CS₂, da sein transparentes „Fenster“ den Bereich abdeckt, in dem CS₂ absorbiert.
Moderne & sicherere Alternativen
Chloroform (CHCl₃) und Dichlormethan (CH₂Cl₂) werden oft als praktischere und weniger toxische Alternativen zu CCl₄ verwendet.
Sie sind insgesamt bessere Lösungsmittel, haben aber mehr C-H-Bindungen, was bedeutet, dass sie mehr störende Peaks aufweisen als CCl₄. Sie bieten jedoch immer noch große, nützliche Fenster und stellen einen guten Kompromiss zwischen spektraler Klarheit und Lösungsmittelnutzen dar. Chloroform beispielsweise ist eine gute Wahl für den Fingerprint-Bereich, weist jedoch C-H-Banden auf, die bei etwa 3000 cm⁻¹ und 1200 cm⁻¹ stören.
Die Abwägungen verstehen
Die Auswahl eines Lösungsmittels ist ein Balanceakt zwischen spektraler Klarheit, Löslichkeit der Probe und Sicherheit.
Die Zwei-Lösungsmittel-Strategie
Die rigoroseste Methode zur Erzielung eines vollständigen Spektrums einer löslichen Verbindung besteht darin, zwei separate Experimente durchzuführen:
- Lösen Sie die Probe in Schwefelkohlenstoff (CS₂) auf, um eine klare Ansicht des Bereichs von 4000 – 1330 cm⁻¹ zu erhalten.
- Lösen Sie eine zweite Probe in Chloroform (CHCl₃) oder CCl₄ auf, um eine klare Ansicht des Bereichs von 1330 – 650 cm⁻¹ zu erhalten.
Anschließend können Sie die nützlichen Teile beider Spektren digital kombinieren, um ein vollständiges, störungsfreies Spektrum zu erstellen.
Das kritische Thema der Toxizität
Viele der „besten“ FTIR-Lösungsmittel sind gefährlich. Tetrachlorkohlenstoff ist ein bekanntes Karzinogen und in den meisten modernen Laboren verboten. Schwefelkohlenstoff ist hochgiftig und extrem entzündlich.
Konsultieren Sie immer ein Sicherheitsdatenblatt (SDB) und verwenden Sie geeignete persönliche Schutzausrüstung (PSA), einschließlich der Arbeit in einem Abzug, wenn Sie mit diesen Chemikalien umgehen. Die Sicherheit diktiert oft die Verwendung eines etwas weniger „perfekten“, aber sichereren Lösungsmittels wie Chloroform oder Dichlormethan.
Die moderne Alternative: Gar kein Lösungsmittel
Für viele flüssige Proben ist das beste Lösungsmittel gar keines. Die ATR-Technik (Attenuated Total Reflectance) ist eine moderne Probenahmetechnik, die die routinemäßige FTIR-Analyse revolutioniert hat.
ATR-FTIR ermöglicht es Ihnen, einen einzelnen Tropfen einer „reinen“ (undiluierten) Flüssigkeit direkt auf eine Kristalloberfläche (oft Diamant) aufzutragen. Der IR-Strahl interagiert mit der Probe an der Grenzfläche und erzeugt ein qualitativ hochwertiges Spektrum ohne jegliche Lösungsmittelinterferenz. Wenn Ihre Probe eine Flüssigkeit ist und Sie über ein ATR-Zubehör verfügen, ist dies fast immer schneller, einfacher und liefert ein saubereres Spektrum als die traditionelle Transmissionsmethode.
Die richtige Wahl für Ihre Analyse treffen
- Wenn Ihr Hauptaugenmerk auf dem C-H-, N-H-, O-H- oder Alkin-Bereich (4000–1330 cm⁻¹) liegt: Ihre beste Wahl ist Schwefelkohlenstoff (CS₂).
- Wenn Ihr Hauptaugenmerk auf dem Fingerprint-Bereich (1330–650 cm⁻¹) liegt: Ihre beste Wahl ist Chloroform (CHCl₃) oder, falls die Sicherheitsprotokolle es zulassen, Tetrachlorkohlenstoff (CCl₄).
- Wenn Sie ein vollständiges, publikationsreifes Spektrum einer Festsubstanz benötigen: Verwenden Sie die Zwei-Lösungsmittel-Strategie, indem Sie ein Spektrum von CS₂ mit einem von CHCl₃ kombinieren.
- Wenn Ihre Probe eine Flüssigkeit ist und Sie Lösungsmittelinterferenzen vollständig vermeiden möchten: Verwenden Sie ein ATR-FTIR-Zubehör, um die reine Flüssigkeit direkt zu analysieren.
Indem Sie verstehen, dass das Ziel darin besteht, spektrale Fenster zu finden, können Sie zuversichtlich ein Lösungsmittel auswählen, das die Struktur Ihrer Probe aufdeckt, anstatt sie zu verdecken.
Zusammenfassungstabelle:
| Lösungsmittel | Optimaler Spektralbereich | Wesentliche Eigenschaften |
|---|---|---|
| Schwefelkohlenstoff (CS₂) | 4000 – 1330 cm⁻¹ (C-H, O-H, N-H) | Minimale Störung im hochfrequenten Bereich; hochgiftig/entzündlich |
| Chloroform (CHCl₃) | 1330 – 650 cm⁻¹ (Fingerprint-Bereich) | Sicherere Alternative zu CCl₄; gut für die Fingerprint-Analyse |
| Tetrachlorkohlenstoff (CCl₄) | 1330 – 650 cm⁻¹ (Fingerprint-Bereich) | Klassische Wahl, aber krebserregend; weitgehend verboten |
| ATR-FTIR (Kein Lösungsmittel) | Voller Bereich (Reine Flüssigkeiten) | Moderne Technik; vermeidet Lösungsmittelinterferenzen vollständig |
Haben Sie Probleme mit Lösungsmittelinterferenzen bei Ihrer FTIR-Analyse? KINTEK ist spezialisiert auf Laborgeräte und Verbrauchsmaterialien und bietet zuverlässige FTIR-Zubehörteile und Lösungsmittel, die auf die Bedürfnisse Ihres Labors zugeschnitten sind. Ob Sie die spektrale Klarheit optimieren oder die Einhaltung von Sicherheitsvorschriften gewährleisten möchten, unsere Expertise hilft Ihnen, genaue, störungsfreie Ergebnisse zu erzielen. Kontaktieren Sie uns noch heute, um die perfekte Lösung für Ihre FTIR-Herausforderungen zu finden!
Visuelle Anleitung
Ähnliche Produkte
- Kupfersulfat-Referenzelektrode für Laboranwendungen
- Kundenspezifischer PTFE-Teflon-Teilehersteller für PTFE-Maschensieb F4
- Bombenförmige Sonde für den Stahlproduktionsprozess
- Labor-Vibrationssiebmaschine Schlagvibrationssieb
- RF PECVD System Hochfrequenz-Plasma-unterstützte chemische Gasphasenabscheidung RF PECVD
Andere fragen auch
- Welche Schritte zur Vorbehandlung sind vor der Verwendung einer tragbaren Kupfer(II)-sulfat-Bezugselektrode erforderlich? Gewährleistung genauer Korrosionspotentialmessungen
- Was ist das Funktionsprinzip einer Kupfer(II)-sulfat-Referenzelektrode? Zuverlässige Potenzialmessung erklärt
- Wie hoch ist die erwartete Lebensdauer einer Kupfersulfat-Referenzelektrode? Maximieren Sie die Langlebigkeit durch richtige Wartung
- Was sind die Vor- und Nachteile der Kupfersulfat-Referenzelektrode mit Holzstopfen? Geschwindigkeit vs. Haltbarkeit erklärt
- Welche Vorsichtsmaßnahmen sollten beim Umgang mit und der Verwendung einer Kupfersulfat-Referenzelektrode getroffen werden? Sorgen Sie für genaue elektrochemische Messungen



















