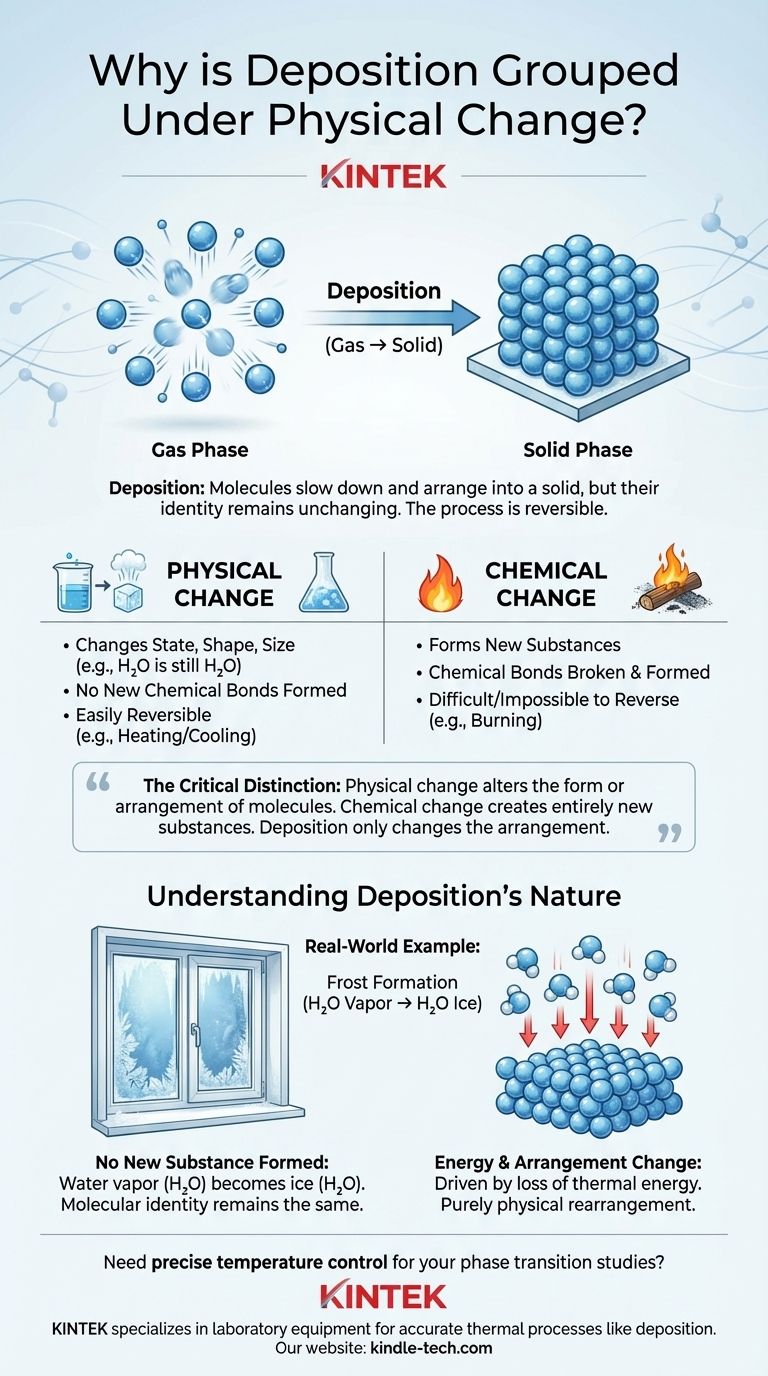
Deposition wird als physikalische Veränderung eingestuft, da sie lediglich den Zustand einer Substanz ändert, nicht aber ihre grundlegende chemische Identität. Während der Deposition gehen die Moleküle einer Substanz direkt vom gasförmigen in den festen Zustand über, wobei sich ihre Anordnung und ihr Energieniveau ändern, die Moleküle selbst jedoch intakt und unverändert bleiben.
Der entscheidende Unterschied ist dieser: Eine physikalische Veränderung verändert die Form oder Anordnung von Molekülen, während eine chemische Veränderung Bindungen bricht und bildet, um völlig neue Substanzen zu erzeugen. Deposition ändert nur die Anordnung.

Die Trennlinie: Physikalische vs. Chemische Veränderung
Um zu verstehen, warum Deposition eindeutig in die physikalische Kategorie fällt, müssen wir zunächst eine klare Definition für beide Arten von Veränderungen festlegen. Der Unterschied liegt darin, was auf molekularer Ebene geschieht.
Was kennzeichnet eine physikalische Veränderung?
Eine physikalische Veränderung beeinflusst die physikalischen Eigenschaften einer Substanz, ohne deren chemische Zusammensetzung zu verändern. Diese Veränderungen beziehen sich hauptsächlich auf Energie und die Anordnung der Partikel.
Wesentliche Merkmale sind Zustandsänderungen (fest, flüssig, gasförmig), Form oder Größe. Ein klassisches Beispiel ist Wasser: Eis, flüssiges Wasser und Wasserdampf sind alle H₂O. Nur der Abstand und die Energie der Moleküle haben sich geändert.
Diese Veränderungen sind oft durch physikalische Mittel, wie Erhitzen oder Abkühlen, leicht reversibel.
Was kennzeichnet eine chemische Veränderung?
Eine chemische Veränderung oder chemische Reaktion führt zur Bildung einer oder mehrerer völlig neuer Substanzen mit unterschiedlichen Eigenschaften und Zusammensetzungen.
Dieser Prozess beinhaltet das Brechen bestehender chemischer Bindungen und die Bildung neuer. Wenn zum Beispiel Holz brennt, reagiert es mit Sauerstoff zu Asche, Kohlendioxid und Wasser – Substanzen, die chemisch vom ursprünglichen Holz verschieden sind.
Chemische Veränderungen sind in der Regel schwer oder unmöglich durch einfache physikalische Mittel rückgängig zu machen.
Analyse der Deposition auf molekularer Ebene
Wenn wir diesen Rahmen auf die Deposition anwenden, wird ihre Klassifizierung klar.
Der Prozess der Deposition erklärt
Deposition ist der direkte Phasenübergang einer Substanz von einem Gas in einen Feststoff, wobei die intermediäre flüssige Phase vollständig übersprungen wird.
Ein häufiges reales Beispiel ist die Bildung von Frost. An einem kalten Morgen kommt Wasserdampf in der Luft (ein Gas) mit einer Oberfläche unterhalb des Gefrierpunkts, wie einer Fensterscheibe, in Kontakt und verwandelt sich direkt in Eiskristalle (einen Feststoff).
Es werden keine neuen Substanzen gebildet
Dies ist der wichtigste Punkt. Der Wasserdampf in der Luft hat die chemische Formel H₂O. Die Eiskristalle, die sich als Frost bilden, haben ebenfalls die chemische Formel H₂O.
Die molekulare Identität der Substanz hat sich nicht geändert. Es wurden keine chemischen Bindungen innerhalb der Wassermoleküle gebrochen, und es wurden keine neuen Substanzen geschaffen.
Es ist eine Veränderung in Energie und Anordnung
Der Übergang wird durch einen Verlust an Wärmeenergie angetrieben. Die energiereichen, sich schnell bewegenden Wassermoleküle im gasförmigen Zustand verlieren Energie, wenn sie die kalte Oberfläche berühren.
Dieser Energieverlust bewirkt, dass sie langsamer werden und sich zu einer festen, geordneten kristallinen Struktur anordnen – dem festen Zustand. Die Veränderung ist rein eine der physikalischen Anordnung und Energie, nicht der chemischen Zusammensetzung.
Verständnis der Kompromisse und häufigen Missverständnisse
Die Verwechslung von physikalischen und chemischen Veränderungen ist häufig, besonders wenn eine dramatische visuelle Veränderung auftritt.
Der Trugschluss des „neuen Aussehens“
Eine Substanz, die eine Deposition durchläuft, wie unsichtbarer Wasserdampf, der sichtbaren Frost bildet, kann den Eindruck erwecken, dass ein neues Material entstanden ist. Eine Veränderung des Aussehens ist jedoch ein Merkmal einer physikalischen Veränderung.
Konzentrieren Sie sich immer auf die chemische Zusammensetzung, nicht auf die visuelle Form. Farbe, Textur und Zustand sind physikalische Eigenschaften, die sich ohne eine chemische Reaktion ändern können.
Reversibilität als starker Indikator
Deposition ist ein reversibler Prozess. Der umgekehrte Prozess, bei dem ein Feststoff direkt in ein Gas übergeht, wird Sublimation genannt. Zum Beispiel sublimiert Trockeneis (festes CO₂) zu CO₂-Gas.
Die Fähigkeit, den Prozess durch einfaches Hinzufügen von Energie (Erhitzen) ohne eine chemische Reaktion umzukehren, ist ein starker Hinweis darauf, dass es sich um eine physikalische Veränderung handelt.
Wie man jede Veränderung korrekt klassifiziert
Um festzustellen, ob ein Prozess physikalisch oder chemisch ist, stellen Sie sich eine Reihe gezielter Fragen.
- Wenn Ihr Hauptaugenmerk auf der Identifizierung einer physikalischen Veränderung liegt: Fragen Sie: „Ist die zugrunde liegende chemische Formel der Substanz vor und nach der Veränderung dieselbe?“
- Wenn Ihr Hauptaugenmerk auf der Identifizierung einer chemischen Veränderung liegt: Fragen Sie: „Wurden chemische Bindungen gebrochen oder gebildet, um eine neue Substanz mit anderen Eigenschaften zu erzeugen?“
- Im Zweifelsfall bei einem Prozess: Fragen Sie: „Kann diese Veränderung durch einfache physikalische Mittel, wie Erhitzen, Abkühlen oder Auflösen, leicht rückgängig gemacht werden?“
Die Konzentration auf die unveränderliche Identität der Moleküle ist der Schlüssel zur genauen Unterscheidung zwischen physikalischen und chemischen Prozessen.
Zusammenfassungstabelle:
| Aspekt | Physikalische Veränderung | Chemische Veränderung |
|---|---|---|
| Molekulare Identität | Bleibt gleich (z.B. H₂O bleibt H₂O) | Ändert sich (neue Substanzen gebildet) |
| Bindungsänderung | Kein Brechen/Bilden chemischer Bindungen | Bindungen gebrochen und neue gebildet |
| Reversibilität | Leicht reversibel (z.B. Erhitzen/Abkühlen) | Schwer oder unmöglich umzukehren |
| Beispielprozess | Deposition (Gas → Feststoff), Gefrieren | Verbrennen, Rosten, Verdauung |
Benötigen Sie eine präzise Temperaturkontrolle für Ihre Phasenübergangsstudien? KINTEK ist spezialisiert auf Laborgeräte und Verbrauchsmaterialien, die für genaue thermische Prozesse wie Deposition und Sublimation entwickelt wurden. Ob Sie Materialwissenschaften erforschen oder Bildungsexperimente durchführen, unsere zuverlässigen Werkzeuge gewährleisten konsistente Ergebnisse. Kontaktieren Sie noch heute unsere Experten, um die perfekte Lösung für die Anforderungen Ihres Labors zu finden!
Visuelle Anleitung
Ähnliche Produkte
- RF PECVD System Hochfrequenz-Plasma-unterstützte chemische Gasphasenabscheidung RF PECVD
- Chemische Gasphasenabscheidung CVD-Anlagenkammer-Schiebe-PECVD-Rohröfen mit Flüssiggasifikator PECVD-Maschine
- Schräges Plasma-unterstütztes chemisches Gasphasenabscheidungs-PECVD-Röhrenofen-Gerät
- Kundenspezifische vielseitige CVD-Rohröfen-Systemausrüstung für die chemische Gasphasenabscheidung
- Elektronenstrahlverdampferbeschichtung Sauerstofffreier Kupfertiegel und Verdampferschiffchen
Andere fragen auch
- Was ist der Sputterprozess bei Metallen? Ein Leitfaden zur Präzisions-Dünnschichtabscheidung
- Warum ist schrittweises Trocknen in einem Blast-Trocknungsofen für Aluminiumoxid-basierte Tiegel-Grünkörper notwendig? Sicherstellung der strukturellen Integrität
- Wie hoch ist die Temperatur bei der Regeneration von Aktivkohle? Entdecken Sie den 540°C-Prozess zur Wiederverwendung
- Kann man Schimmel mit einer Infrarotkamera sehen? Wie Wärmebildkameras versteckte Feuchtigkeitsprobleme aufdecken
- Was ist Wärmebehandlung in einfachen Worten? Ein Leitfaden zur Transformation von Materialeigenschaften
- Was ist die Brenntemperatur eines Ofens? Von 200°C bis 3000°C, es hängt von Ihren Bedürfnissen ab
- Welche Rolle spielt ein Labor-Trockenschrank mit konstanter Temperatur bei der anaeroben Vergärung? Präzisions-TS-Analyse
- Was ist ein Chargenofen? Erreichen Sie eine perfekte Prozesskontrolle für sensible Anwendungen



















