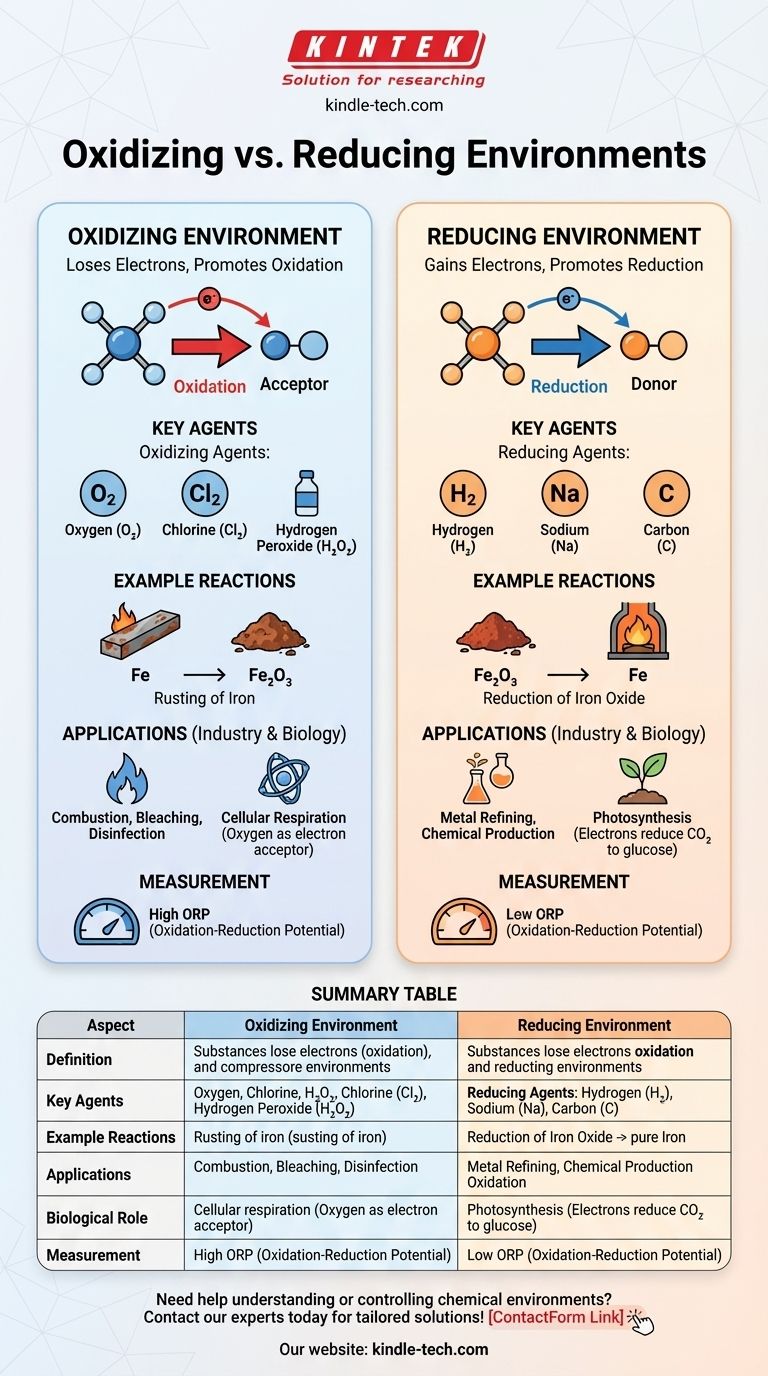
In der Chemie ist eine oxidierende Umgebung eine, in der Substanzen tendenziell Elektronen abgeben, was Oxidationsreaktionen fördert, während eine reduzierende Umgebung eine ist, in der Substanzen tendenziell Elektronen aufnehmen, was Reduktionsreaktionen fördert. Der Hauptunterschied liegt in der Verfügbarkeit von Elektronenakzeptoren (Oxidationsmitteln) oder Elektronendonatoren (Reduktionsmitteln). Oxidierende Umgebungen sind durch die Anwesenheit von Oxidationsmitteln wie Sauerstoff oder Halogenen gekennzeichnet, die den Elektronenverlust erleichtern. Im Gegensatz dazu enthalten reduzierende Umgebungen Reduktionsmittel wie Wasserstoff oder Metalle, die die Elektronenaufnahme erleichtern. Diese Umgebungen spielen eine entscheidende Rolle in chemischen Reaktionen, industriellen Prozessen und biologischen Systemen.

Wichtige Punkte erklärt:
-
Definition von oxidierenden und reduzierenden Umgebungen:
- Oxidierende Umgebung: Eine chemische Umgebung, in der Substanzen eher Elektronen abgeben, was zur Oxidation führt. Diese Umgebung ist reich an Oxidationsmitteln wie Sauerstoff, Chlor oder anderen Elektronenakzeptoren.
- Reduzierende Umgebung: Eine chemische Umgebung, in der Substanzen eher Elektronen aufnehmen, was zur Reduktion führt. Diese Umgebung ist reich an Reduktionsmitteln wie Wasserstoff, Metallen oder anderen Elektronendonatoren.
-
Rolle von Oxidations- und Reduktionsmitteln:
- Oxidationsmittel: Dies sind Substanzen, die Elektronen von anderen Substanzen aufnehmen und diese dadurch oxidieren. Häufige Beispiele sind Sauerstoff (O₂), Chlor (Cl₂) und Wasserstoffperoxid (H₂O₂).
- Reduktionsmittel: Dies sind Substanzen, die Elektronen an andere Substanzen abgeben und diese dadurch reduzieren. Häufige Beispiele sind Wasserstoff (H₂), Natrium (Na) und Kohlenstoff (C).
-
Chemische Reaktionen in verschiedenen Umgebungen:
- Oxidierende Umgebung: In einer solchen Umgebung dominieren Oxidationsreaktionen. Zum Beispiel tritt die Rostbildung von Eisen in einer oxidierenden Umgebung auf, in der Eisen (Fe) Elektronen an Sauerstoff abgibt und Eisenoxid (Fe₂O₃) bildet.
- Reduzierende Umgebung: In einer solchen Umgebung dominieren Reduktionsreaktionen. Zum Beispiel erfolgt die Reduktion von Metalloxiden zu reinen Metallen in einer reduzierenden Umgebung, wie wenn Kohlenstoff verwendet wird, um Eisenoxid in einem Hochofen zu Eisen zu reduzieren.
-
Anwendungen in Industrie und Biologie:
- Industrielle Anwendungen: Oxidierende Umgebungen werden bei Prozessen wie Verbrennung, Bleichen und Desinfektion eingesetzt. Reduzierende Umgebungen sind entscheidend bei Prozessen wie der Metallraffination und der Herstellung bestimmter Chemikalien.
- Biologische Systeme: In biologischen Systemen finden sich oxidierende Umgebungen bei Prozessen wie der Zellatmung, bei der Sauerstoff als letzter Elektronenakzeptor fungiert. Reduzierende Umgebungen finden sich bei Prozessen wie der Photosynthese, bei der Elektronen gespendet werden, um Kohlendioxid zu Glukose zu reduzieren.
-
Messung und Kontrolle:
- Oxidations-Reduktions-Potenzial (ORP): Der ORP ist ein Maß für die Tendenz einer chemischen Umgebung, Elektronen aufzunehmen oder abzugeben. Ein hoher ORP deutet auf eine oxidierende Umgebung hin, während ein niedriger ORP auf eine reduzierende Umgebung hindeutet.
- Kontrolle in industriellen Prozessen: In der Industrie ist die Kontrolle des oxidierenden oder reduzierenden Charakters der Umgebung entscheidend für die Optimierung chemischer Reaktionen, die Sicherstellung der Produktqualität und die Vermeidung unerwünschter Nebenreaktionen.
-
Beispiele für oxidierende und reduzierende Umgebungen:
- Oxidierende Umgebung: Die Erdatmosphäre ist aufgrund der Anwesenheit von Sauerstoff eine oxidierende Umgebung. Deshalb korrodieren Metalle wie Eisen, wenn sie der Luft ausgesetzt sind.
- Reduzierende Umgebung: Das Innere eines Hochofens ist eine reduzierende Umgebung, in der Kohlenmonoxid (CO) als Reduktionsmittel wirkt, um Eisenerz (Fe₂O₃) in metallisches Eisen (Fe) umzuwandeln.
Durch das Verständnis der Unterschiede zwischen oxidierenden und reduzierenden Umgebungen können Chemiker und Ingenieure chemische Reaktionen in verschiedenen Anwendungen, von industriellen Prozessen bis hin zu biologischen Systemen, besser steuern und optimieren.
Zusammenfassungstabelle:
| Aspekt | Oxidierende Umgebung | Reduzierende Umgebung |
|---|---|---|
| Definition | Substanzen geben Elektronen ab (Oxidation) aufgrund von Elektronenakzeptoren wie Sauerstoff oder Halogenen. | Substanzen nehmen Elektronen auf (Reduktion) aufgrund von Elektronendonatoren wie Wasserstoff oder Metallen. |
| Schlüsselagenzien | Oxidationsmittel: Sauerstoff (O₂), Chlor (Cl₂), Wasserstoffperoxid (H₂O₂). | Reduktionsmittel: Wasserstoff (H₂), Natrium (Na), Kohlenstoff (C). |
| Beispielreaktionen | Rostbildung von Eisen (Fe → Fe₂O₃). | Reduktion von Eisenoxid zu Eisen (Fe₂O₃ → Fe). |
| Anwendungen | Verbrennung, Bleichen, Desinfektion. | Metallraffination, chemische Produktion. |
| Biologische Rolle | Zellatmung (Sauerstoff als Elektronenakzeptor). | Photosynthese (Elektronen reduzieren CO₂ zu Glukose). |
| Messung | Hohes Oxidations-Reduktions-Potenzial (ORP). | Niedriges Oxidations-Reduktions-Potenzial (ORP). |
Benötigen Sie Hilfe beim Verständnis oder der Kontrolle chemischer Umgebungen? Kontaktieren Sie noch heute unsere Experten für maßgeschneiderte Lösungen!
Visuelle Anleitung
Ähnliche Produkte
- Kontrollierter Hochtemperatur-Wasserstoff-Ofen
- HFCVD-Maschinensystemausrüstung für Ziehstein-Nanodiamantbeschichtung
- Kundenspezifische vielseitige CVD-Rohröfen-Systemausrüstung für die chemische Gasphasenabscheidung
- Labormaßstabs Induktionsschmelzofen mit Vakuum
- Graphit-Vakuumofen für negatives Elektrodenmaterial
Andere fragen auch
- Warum wird hochreines Argon für die Verarbeitung von 12Kh18N10T-Stahl benötigt? Schützen Sie Ihre Oberflächenintegrität und Datenzuverlässigkeit
- Warum wird Stickstoff in Glühöfen verwendet? Um Oxidation und Entkohlung für eine überlegene Metallqualität zu verhindern
- Was sind die wichtigsten Methoden zur Steuerung des Kohlenstoffpotenzials einer erzeugten Ofenatmosphäre? Präzise Wärmebehandlung meistern
- Welche Vorteile bietet ein Hochtemperatur-Atmosphären-Sinterofen für UO2? Präzise Brennstoffverdichtung
- Warum sind Hochtemperatur-Atmosphärenöfen für die Untersuchung der Oxidationskinetik von Edelstahllegierungen erforderlich?
- Wie stellt ein Drei-Zonen-Split-Atmosphärenofen Genauigkeit sicher? Beherrschen der thermischen Gleichmäßigkeit für Zugprüfungen
- Was ist eine oxidierende Atmosphäre? Wichtige Erkenntnisse zu Oxidationsreaktionen und Anwendungen
- Warum ist ein Hochtemperatur-Ofen mit Atmosphärenkontrolle für BZY20-Keramiken notwendig? Schlüssel zur Protonenaktivierung












