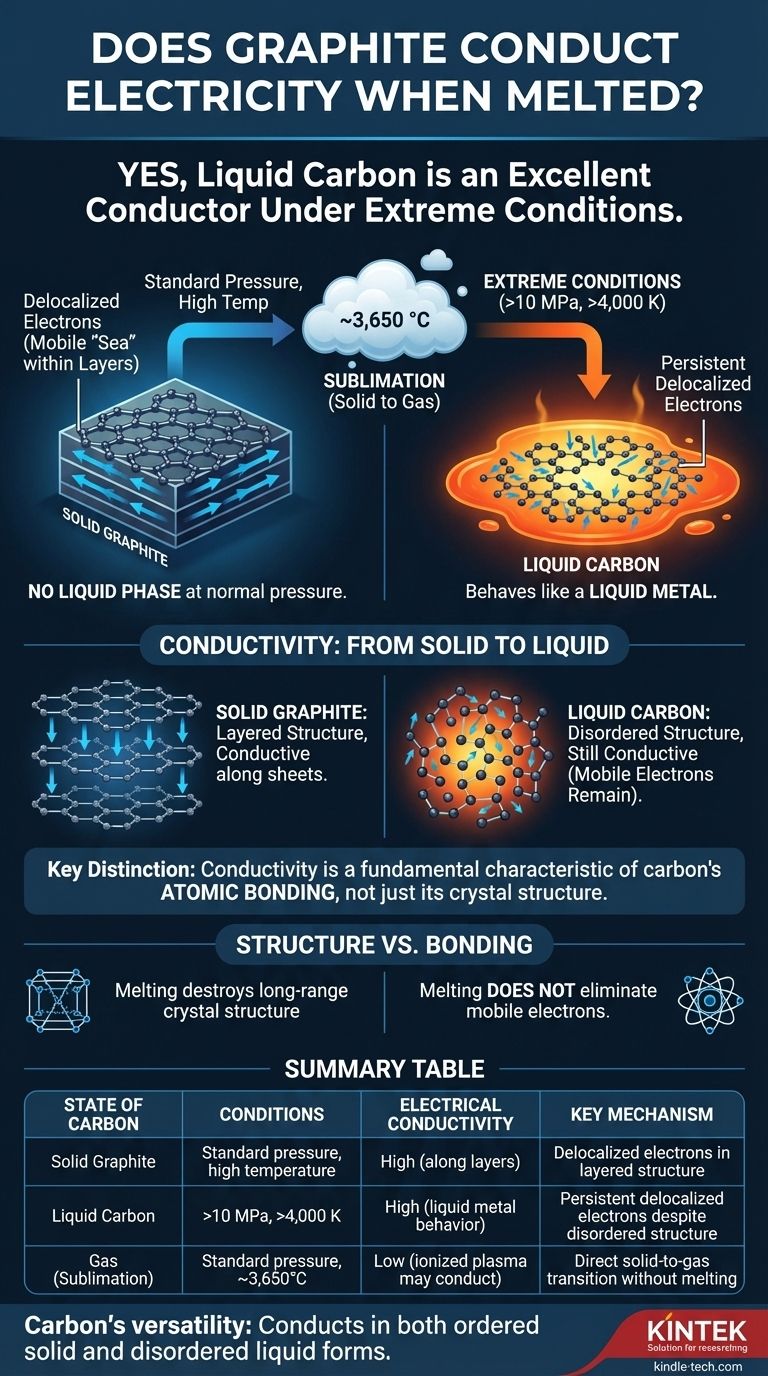
Ja, unter den extremen Bedingungen, die für das Schmelzen erforderlich sind, ist flüssiger Kohlenstoff ein ausgezeichneter elektrischer Leiter. Während Graphit unter normalem atmosphärischem Druck nicht schmilzt, verhält sich der flüssige Kohlenstoff, der bei sehr hohen Drücken und Temperaturen gebildet werden kann, wie ein flüssiges Metall, mit Elektronen, die sich frei bewegen und einen elektrischen Strom leiten können.
Die Frage ist nicht einfach, ob geschmolzener Graphit Elektrizität leitet – das tut er –, sondern warum. Die Antwort zeigt, dass die Leitfähigkeit nicht ausschließlich eine Eigenschaft der berühmten Schichtstruktur von Graphit ist, sondern ein grundlegenderes Merkmal der atomaren Bindung von Kohlenstoff, das auch in einem ungeordneten flüssigen Zustand bestehen bleibt.

Die Herausforderung des Schmelzens von Graphit
Um die Leitfähigkeit in flüssigem Kohlenstoff zu verstehen, müssen wir zunächst erkennen, wie schwierig es ist, ihn zu erzeugen. Für die meisten praktischen Zwecke hat Graphit keine flüssige Phase.
Sublimation, nicht Schmelzen
Bei normalem atmosphärischem Druck verwandelt sich Graphit, wenn er bis an seine Grenze erhitzt wird, nicht in eine Flüssigkeit. Stattdessen sublimiert er – er geht bei Temperaturen um 3.650 °C (6.600 °F) direkt vom festen in den gasförmigen Zustand über.
Die Notwendigkeit extremer Bedingungen
Um Kohlenstoff in einen flüssigen Zustand zu zwingen, müssen Sie gleichzeitig immensen Druck und hohe Temperaturen anwenden. Flüssiger Kohlenstoff existiert nur bei Drücken über 10 Megapascal (~100-mal normaler atmosphärischer Druck) und Temperaturen über 4.000 K (~3.727 °C oder 6.740 °F).
Leitfähigkeit: Vom Feststoff zur Flüssigkeit
Der Grund, warum sowohl fester Graphit als auch flüssiger Kohlenstoff Elektrizität leiten, liegt in der einzigartigen Natur der Kohlenstoffelektronen.
Wie fester Graphit leitet
In festem Graphit sind Kohlenstoffatome in flachen, hexagonalen Schichten angeordnet. Jedes Kohlenstoffatom bildet starke Bindungen mit drei Nachbarn, wodurch sein viertes äußeres Elektron delokalisiert wird.
Diese delokalisierten Elektronen sind nicht an ein einzelnes Atom gebunden. Stattdessen bilden sie ein mobiles „Meer“ von Elektronen innerhalb jeder Schicht, weshalb Graphit ein ausgezeichneter elektrischer Leiter entlang seiner Schichten ist.
Leitfähigkeit im flüssigen Zustand
Wenn Graphit zum Schmelzen gezwungen wird, wird seine starre, geschichtete Struktur zerstört. Die Atome werden ungeordnet und können sich frei bewegen, wie in jeder Flüssigkeit.
Die lokale Bindungsumgebung ermöglicht jedoch weiterhin delokalisierte Elektronen. Die Flüssigkeit ist eine komplexe, fluktuierende Mischung von Bindungstypen, aber die Anwesenheit mobiler Elektronen bleibt bestehen. Dies lässt flüssigen Kohlenstoff sich wie ein flüssiges Metall verhalten, mit hoher elektrischer Leitfähigkeit.
Den Hauptunterschied verstehen
Es ist leicht anzunehmen, dass die Leitfähigkeit von Graphit ausschließlich auf seine schichtartige Struktur zurückzuführen ist. Das Verhalten von flüssigem Kohlenstoff beweist, dass dies ein unvollständiges Bild ist.
Struktur vs. Bindung
Die wichtigste Erkenntnis ist der Unterschied zwischen Struktur und Bindung. Während das Schmelzen die Fernordnung der Kristallstruktur von Graphit zerstört, beseitigt es nicht die grundlegende atomare Bindung, die es Elektronen ermöglicht, mobil zu werden.
Eine praktische Einschränkung
Dieses Phänomen ist hauptsächlich in der extremen Physik und Materialwissenschaft von Interesse. In den meisten technischen Anwendungen, wie z. B. in Lichtbogenöfen, haben Sie es mit einer festen Graphitelektrode zu tun, die zu einem heißen, ionisierten Gas (einem Plasma) sublimiert, nicht mit einem Pool aus flüssigem Kohlenstoff.
Kohlenstoffeigenschaften verstehen
Ihr Verständnis dieses Themas hängt von Ihrem Ziel ab. Verwenden Sie diese Punkte, um das Konzept für Ihren spezifischen Kontext zu formulieren.
- Wenn Ihr Hauptaugenmerk auf der Grundlagenchemie liegt: Die Leitfähigkeit von flüssigem Kohlenstoff zeigt, dass delokalisierte Elektronen, ein Merkmal der sp2-Bindung von Kohlenstoff, nicht verloren gehen, wenn die starre Gitterstruktur schmilzt.
- Wenn Ihr Hauptaugenmerk auf der praktischen Technik liegt: Für praktisch alle Anwendungen gilt: Graphit sublimiert zu einem Gas, lange bevor er schmelzen kann, ein entscheidender Faktor für die Konstruktion von Hochtemperatursystemen.
Letztendlich offenbart die Fähigkeit von Kohlenstoff, Elektrizität sowohl in seiner geordneten festen als auch in seiner ungeordneten flüssigen Form zu leiten, die bemerkenswerte Vielseitigkeit seiner atomaren Bindungen.
Zusammenfassungstabelle:
| Zustand des Kohlenstoffs | Erforderliche Bedingungen | Elektrische Leitfähigkeit | Schlüsselmechanismus |
|---|---|---|---|
| Fester Graphit | Standarddruck, hohe Temperatur | Hoch (entlang der Schichten) | Delokalisierte Elektronen in Schichtstruktur |
| Flüssiger Kohlenstoff | >10 MPa, >4.000 K | Hoch (Verhalten wie flüssiges Metall) | Anhaltende delokalisierte Elektronen trotz ungeordneter Struktur |
| Gas (Sublimation) | Standarddruck, ~3.650 °C | Niedrig (ionisiertes Plasma kann leiten) | Direkter Übergang von fest zu gasförmig ohne Schmelzen |
Erzielen Sie Präzision in der Hochtemperaturforschung mit KINTEK
Das Verständnis extremer Materialverhaltensweisen, wie der Leitfähigkeit von flüssigem Kohlenstoff, erfordert zuverlässige Laborgeräte. KINTEK ist spezialisiert auf Hochleistungs-Laboröfen, Elektroden und Verbrauchsmaterialien, die für anspruchsvolle Bedingungen entwickelt wurden. Ob Sie Materialwissenschaften erforschen oder fortschrittliche technische Systeme entwickeln, unsere Produkte gewährleisten Genauigkeit und Langlebigkeit.
Bereit, die Fähigkeiten Ihres Labors zu verbessern? Kontaktieren Sie uns noch heute, um zu besprechen, wie die Lösungen von KINTEK Ihre Hochtemperaturexperimente und Forschungsziele unterstützen können.
Visuelle Anleitung
Ähnliche Produkte
- Vertikaler Hochtemperatur-Graphit-Vakuum-Graphitierungs-Ofen
- Graphit-Vakuum-Durchlaufgraphitierungsöfen
- Graphitierungs-Vakuumofen für ultrahohe Temperaturen
- Graphit-Vakuumofen Hochwärmeleitfähige Folien-Graphitierungsöfen
- 1400℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
Andere fragen auch
- Ist Graphit für hohe Temperaturen geeignet? Entfalten Sie sein volles Potenzial in kontrollierten Atmosphären
- Was ist isostatischer Graphit? Das ultimative Material für Hightech- und Hochtemperaturanwendungen
- Was ist das Grundprinzip der Graphitrohr-Atomabsorptionsspektroskopie? Ultra-Spurenelementnachweis erreichen
- Was sind die Vorteile des Graphitofens gegenüber der Flamme? Erzielen Sie eine überragende Empfindlichkeit bei der Spurenanalyse
- Was ist der Unterschied zwischen extrudiertem und isostatischem Graphit? Ein Leitfaden zur Auswahl des richtigen Materials
- Was ist die Graphitofen-Technik? Erzielen Sie extreme Temperaturen für fortschrittliche Materialien
- Wie wird synthetischer Graphit hergestellt? Ein tiefer Einblick in den Hochtemperaturprozess
- Was sind die Stufen des Graphitofens? Ein Leitfaden zur präzisen mehrstufigen Temperaturprogrammierung



















