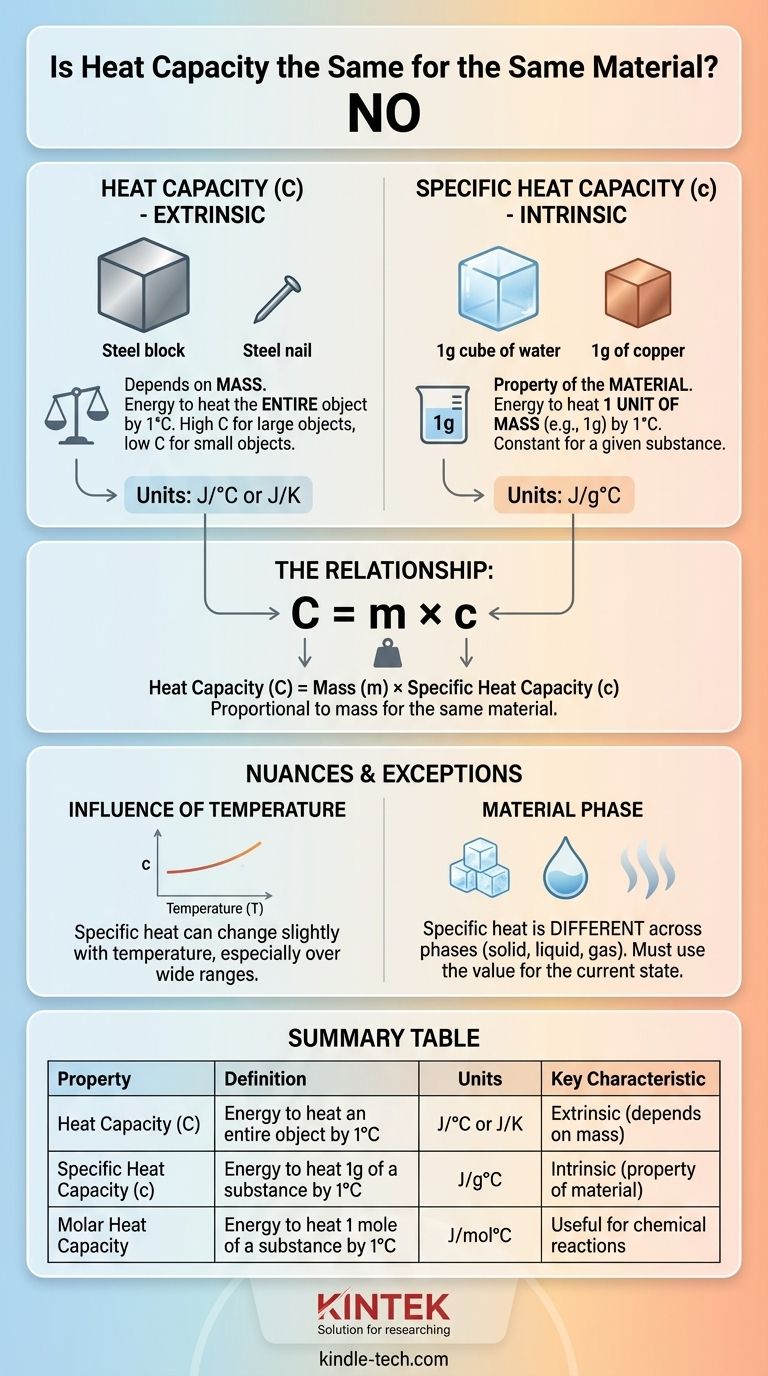
Kurz gesagt, nein. Die Wärmekapazität eines Objekts ist für das gleiche Material nicht gleich, wenn die Materialmenge unterschiedlich ist. Die Wärmekapazität hängt direkt von der Masse eines Objekts ab. Ein großer Stahlblock hat daher eine viel höhere Wärmekapazität als ein kleiner Stahlstift. Die Eigenschaft, an die Sie denken und die für ein Material konstant ist, wird als spezifische Wärmekapazität bezeichnet.
Der Kernunterschied ist dieser: Die Wärmekapazität ist eine extrinsische Eigenschaft eines bestimmten Objekts (wie viel Energie benötigt wird, um das Ganze zu erwärmen), während die spezifische Wärmekapazität eine intrinsische Eigenschaft einer Substanz ist (wie viel Energie benötigt wird, um eine festgelegte Menge, z. B. ein Gramm, zu erwärmen). Die Verwechslung der beiden ist eine häufige Fehlerquelle.

Definition der Schlüsselkonzepte: Wärmekapazität vs. Spezifische Wärme
Um Probleme im Zusammenhang mit thermischer Energie zu lösen, müssen Sie zunächst bei Ihren Begriffen präzise sein. Der Unterschied zwischen „Wärmekapazität“ und „spezifischer Wärmekapazität“ ist grundlegend.
Was ist Wärmekapazität (C)?
Die Wärmekapazität ist die Menge an Wärmeenergie, die erforderlich ist, um die Temperatur eines gesamten Objekts um ein Grad (Celsius oder Kelvin) zu erhöhen.
Betrachten Sie sie als die thermische Trägheit eines bestimmten Objekts. Ein großes Schwimmbecken benötigt eine enorme Energiemenge, um sich um ein Grad zu erwärmen, es hat also eine hohe Wärmekapazität. Eine kleine Tasse Wasser benötigt weitaus weniger Energie, sie hat also eine niedrige Wärmekapazität.
Da sie von der Größe des Objekts abhängt, ist die Wärmekapazität eine extrinsische Eigenschaft. Ihre Einheit ist typischerweise Joule pro Grad Celsius (J/°C) oder Joule pro Kelvin (J/K).
Was ist spezifische Wärmekapazität (c)?
Die spezifische Wärmekapazität ist die Menge an Wärmeenergie, die erforderlich ist, um die Temperatur von einer Masseneinheit (wie einem Gramm oder einem Kilogramm) einer Substanz um ein Grad zu erhöhen.
Dies ist der Wert, den Sie in Referenztabellen für Materialien finden. Er ermöglicht einen fairen Vergleich zwischen Substanzen. Wasser hat beispielsweise eine sehr hohe spezifische Wärmekapazität (4,184 J/g°C), während Kupfer eine niedrige hat (0,385 J/g°C).
Das bedeutet, dass viel mehr Energie benötigt wird, um ein Gramm Wasser zu erwärmen, als um ein Gramm Kupfer zu erwärmen. Da sie pro Masseneinheit standardisiert ist, ist die spezifische Wärme eine intrinsische Eigenschaft einer Substanz.
Die mathematische Beziehung
Der Zusammenhang zwischen diesen beiden Eigenschaften ist einfach und direkt. Die Wärmekapazität eines Objekts ist seine Masse multipliziert mit der spezifischen Wärmekapazität des Materials.
Wärmekapazität (C) = Masse (m) × spezifische Wärmekapazität (c)
Diese Formel zeigt deutlich, dass, wenn Sie zwei Objekte aus dem gleichen Material haben (gleiches c), dasjenige mit der größeren Masse (m) eine proportional größere Wärmekapazität (C) aufweist.
Nuancen und Ausnahmen verstehen
Obwohl die spezifische Wärme als Konstante für ein gegebenes Material angesehen wird, hat diese Annahme in realen technischen und wissenschaftlichen Anwendungen wichtige Grenzen.
Der Einfluss der Temperatur
Für die meisten alltäglichen Berechnungen wird die spezifische Wärme als konstant behandelt. In Wirklichkeit kann sich die spezifische Wärme eines Materials jedoch geringfügig mit der Temperatur ändern.
In hochpräzisen Bereichen wie der Luft- und Raumfahrt oder der Materialwissenschaft müssen Ingenieure berücksichtigen, wie sich die spezifische Wärme eines Materials ändert, wenn es sich über einen weiten Bereich erwärmt oder abkühlt.
Die entscheidende Rolle der Materialphase
Die spezifische Wärmekapazität einer Substanz ist über ihre verschiedenen Phasen (fest, flüssig, gasförmig) nicht gleich.
Das häufigste Beispiel ist Wasser. Die spezifische Wärme von festem Eis unterscheidet sich von der von flüssigem Wasser, die sich ebenfalls von der von gasförmigem Dampf unterscheidet. Bei Berechnungen müssen Sie den Wert verwenden, der dem aktuellen Zustand des Materials entspricht.
Molare Wärmekapazität: Eine andere Perspektive
In der Chemie ist es oft nützlicher, die Menge einer Substanz in Mol statt in Masse anzugeben.
Die molare Wärmekapazität ist die Energie, die erforderlich ist, um ein Mol einer Substanz um ein Grad zu erwärmen. Dies ist besonders nützlich bei der Analyse chemischer Reaktionen, bei denen die Anzahl der Moleküle der Schlüsselfaktor ist.
Wie man dieses Wissen korrekt anwendet
Die Wahl des richtigen Begriffs hängt vollständig davon ab, was Sie beschreiben oder berechnen möchten.
- Wenn Ihr Hauptaugenmerk auf einem bestimmten Objekt liegt: Verwenden Sie die Wärmekapazität (C), um die Gesamtenergie zu verstehen, die erforderlich ist, um dieses gesamte Objekt zu erwärmen, z. B. einen Motorblock, einen Kühlkörper oder eine Pfanne.
- Wenn Ihr Hauptaugenmerk auf einer Substanz oder einem Material liegt: Verwenden Sie die spezifische Wärmekapazität (c), um die inhärenten thermischen Eigenschaften verschiedener Materialien zu vergleichen, z. B. bei der Auswahl zwischen Aluminium und Kupfer für eine bestimmte Anwendung.
- Wenn Ihr Hauptaugenmerk auf einer chemischen Reaktion liegt: Ziehen Sie die Verwendung der molaren Wärmekapazität in Betracht, da diese Energieänderungen direkt auf die Anzahl der an dem Prozess beteiligten Moleküle bezieht.
Die Unterscheidung zwischen der Eigenschaft eines Objekts und der Eigenschaft einer Substanz ist der Schlüssel zur Beherrschung thermischer Berechnungen.
Zusammenfassungstabelle:
| Eigenschaft | Definition | Einheiten | Schlüsselmerkmal |
|---|---|---|---|
| Wärmekapazität (C) | Energie zum Erwärmen eines gesamten Objekts um 1°C | J/°C oder J/K | Extrinsisch (abhängig von der Masse) |
| Spezifische Wärmekapazität (c) | Energie zum Erwärmen von 1 g einer Substanz um 1°C | J/g°C | Intrinsisch (Eigenschaft des Materials) |
| Molare Wärmekapazität | Energie zum Erwärmen von 1 Mol einer Substanz um 1°C | J/mol°C | Nützlich für chemische Reaktionen |
Eine genaue thermische Analyse ist entscheidend für den Erfolg Ihres Labors.
Das Verständnis der genauen thermischen Eigenschaften Ihrer Materialien ist grundlegend für zuverlässige Forschung, Entwicklung und Qualitätskontrolle. Ob Sie neue Materialien charakterisieren, einen thermischen Prozess optimieren oder die richtige Ausrüstung auswählen – präzise Daten zur Wärmekapazität sind nicht verhandelbar.
KINTEK ist spezialisiert auf die Bereitstellung hochwertiger Laborgeräte und Verbrauchsmaterialien, die Sie für diese kritischen Messungen mit Zuversicht benötigen. Von Kalorimetern bis hin zu Temperaturregelsystemen sind unsere Lösungen darauf ausgelegt, die Genauigkeit und Zuverlässigkeit zu liefern, die Labore fordern.
Lassen Sie KINTEK Ihr Partner für Präzision sein. Kontaktieren Sie noch heute unsere Experten, um Ihre spezifische Anwendung zu besprechen und herauszufinden, wie unsere Produkte Ihre Fähigkeiten in der thermischen Analyse verbessern können.
Visuelle Anleitung
Ähnliche Produkte
- Hochtemperatur-Konstanttemperatur-Heizzirkulator Wasserbad-Kühler-Zirkulator für Reaktionsbad
- 10L Heiz-Kühl-Umwälzgerät Kühlwasserbad-Umwälzgerät für konstante Temperaturreaktion bei hohen und niedrigen Temperaturen
- Kundenspezifischer PTFE-Teflon-Teilehersteller für PTFE-Maschensieb F4
- Labor-Vibrationssiebmaschine Schlagvibrationssieb
- Glassy Carbon Sheet RVC für elektrochemische Experimente
Andere fragen auch
- Welche Arten von Öfen gibt es im Labor? Ein Leitfaden zur Auswahl der richtigen Heizgeräte
- Was sind die Produkte des Sinterns? Dauerhafte, komplexe Teile aus Pulver herstellen
- Was ist ein Plasmaofen? Nutzen Sie Ultrahochtemperaturen für die extreme Materialverarbeitung
- Was ist die Funktion einer Laborheizung? Präzises, sicheres und kontrolliertes Erhitzen erreichen
- Was sind die Nachteile von Metalleisen? Wesentliche Einschränkungen und warum wir stattdessen Legierungen verwenden
- Was ist Kalzinierung? Ein Leitfaden zur Hochtemperaturreinigung und -umwandlung
- Wie dick ist gesputtertes Gold? Erreichen Sie eine Präzision im Angström-Bereich für Ihre Anwendung
- Was sind die Verwendungszwecke eines Trockenschranks im Lebensmittelchemielabor? Erzielung präziser Probenvorbereitung und -analyse



















