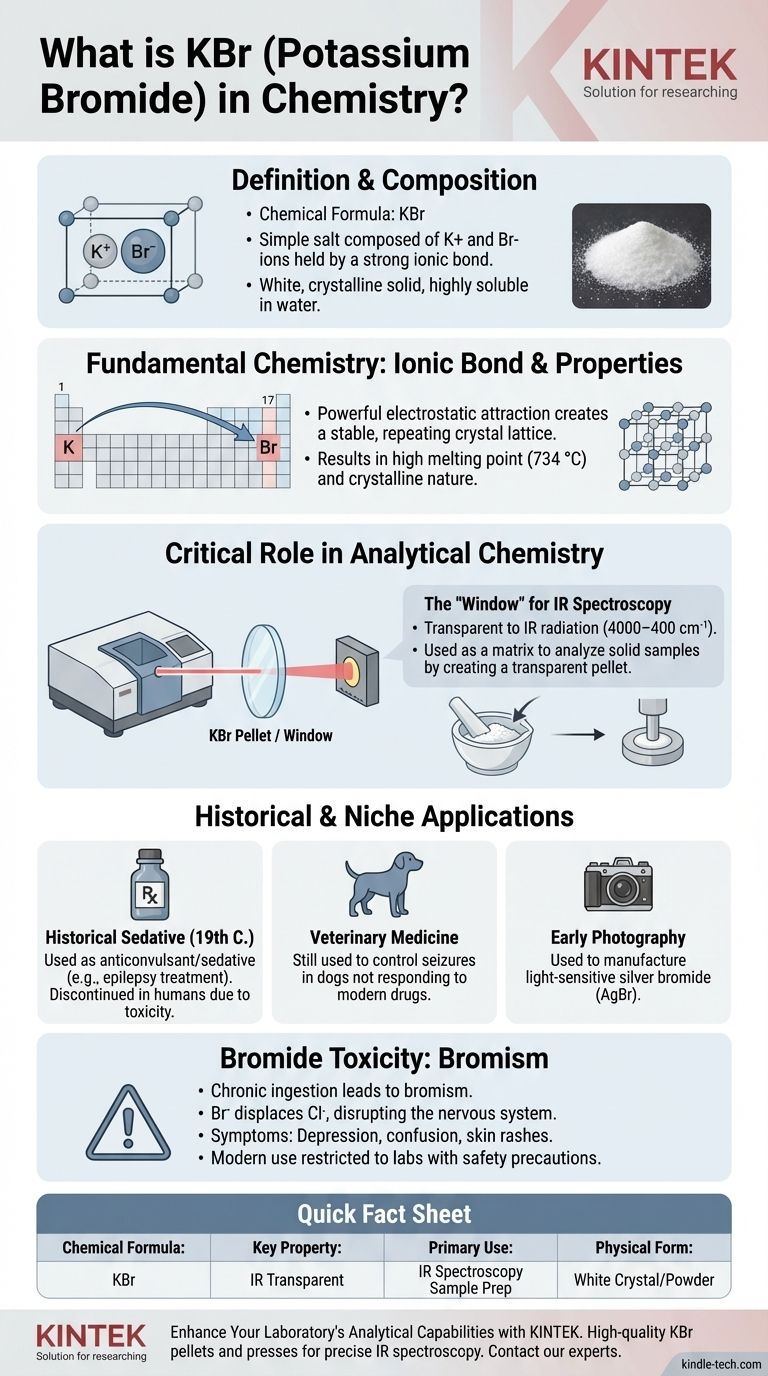
In der Welt der Chemie ist KBr die chemische Formel für Kaliumbromid. Es ist ein einfaches Salz, das aus einem Kaliumion (K+) und einem Bromidion (Br−) besteht, die durch eine starke Ionenbindung zusammengehalten werden. Dieser weiße, kristalline Feststoff ist gut wasserlöslich und eine Standardverbindung, die in den meisten Chemielaboren zu finden ist.
Obwohl es leicht als einfaches Salz definiert werden kann, liegt die wahre Bedeutung von Kaliumbromid in seinen einzigartigen physikalischen Eigenschaften. Seine Transparenz gegenüber Infrarotlicht macht es zu einem unverzichtbaren Werkzeug in der modernen chemischen Analyse, eine Rolle, die seine historische und risikoreichere Verwendung in der Medizin bei weitem überdauert hat.

Die grundlegende Chemie von KBr
Kaliumbromid ist ein Paradebeispiel für eine ionische Verbindung, die aus Elementen von gegenüberliegenden Enden des Periodensystems gebildet wird. Seine Eigenschaften sind ein direktes Ergebnis dieser chemischen Struktur.
Eine ikonische Ionenbindung
Kalium (K) ist ein Alkalimetall der Gruppe 1, das leicht ein Elektron abgibt, um ein positiv geladenes Ion (ein Kation), K+, zu bilden. Brom (Br) ist ein Halogen der Gruppe 17, das leicht ein Elektron aufnimmt, um ein negativ geladenes Ion (ein Anion), Br−, zu bilden.
Die starke elektrostatische Anziehung zwischen diesen entgegengesetzt geladenen Ionen erzeugt eine stabile, sich wiederholende Kristallgitterstruktur. Diese starke Bindung ist für den hohen Schmelzpunkt von KBr (734 °C oder 1353 °F) und seine kristalline Natur verantwortlich.
Wichtige physikalische Eigenschaften
Als Standardreagenz im Labor ist KBr ein weißes, geruchloses Pulver oder Kristall. Seine wichtigste physikalische Eigenschaft für viele Chemiker ist seine hohe Löslichkeit in Wasser, wo es sich vollständig in seine Bestandteile K+- und Br--Ionen dissoziiert.
Die entscheidende Rolle von KBr in der analytischen Chemie
Die bedeutendste moderne Anwendung von Kaliumbromid liegt nicht in chemischen Reaktionen, sondern als Medium für die Analyse, insbesondere in der Infrarot (IR)-Spektroskopie.
Das „Fenster“ für die Infrarotspektroskopie
Die IR-Spektroskopie funktioniert, indem Infrarotlicht durch eine Probe geschickt wird, um zu sehen, welche Frequenzen absorbiert werden. Dieses Absorptionsmuster zeigt die Arten von chemischen Bindungen an, die in einem Molekül vorhanden sind.
KBr ist hier außerordentlich nützlich, da es für IR-Strahlung über einen sehr breiten Frequenzbereich (4000–400 cm⁻¹) transparent ist. Sein einfaches Ionengitter besitzt keine kovalenten Bindungen, die in diesem Bereich vibrieren und IR-Licht absorbieren würden, sodass es keine störenden Signale erzeugt.
Wie KBr-Presslinge hergestellt werden
Um eine feste Probe zu analysieren, wird eine winzige Menge mit trockenem KBr zu einem feinen Pulver zermahlen. Diese Mischung wird dann in eine Presse gegeben und mit mehreren Tonnen Druck komprimiert.
Die weiche, salzartige Beschaffenheit von KBr ermöglicht es ihm, sich unter Druck zu verformen und eine dünne, transparente oder durchscheinende Scheibe zu bilden, die oft als KBr-Pressling oder -Fenster bezeichnet wird. Die Probe wird in dieser KBr-Matrix eingeschlossen, wodurch der IR-Strahl zur Analyse hindurchtreten kann.
Historische und Nischenanwendungen
Bevor es zu einem Eckpfeiler der Spektroskopie wurde, hatte KBr eine lange und vielfältige Geschichte, insbesondere in der Medizin.
Ein Beruhigungsmittel der Vergangenheit
Im 19. und frühen 20. Jahrhundert wurde Kaliumbromid häufig als Antikonvulsivum und Beruhigungsmittel eingesetzt. Es war eine der ersten wirksamen Behandlungen für Epilepsie.
Veterinärmedizin
Obwohl seine Anwendung beim Menschen aufgrund seiner Toxizität eingestellt wurde, wird KBr immer noch in der Veterinärmedizin eingesetzt, hauptsächlich zur Kontrolle von Anfällen bei Hunden, die nicht auf modernere Medikamente ansprechen.
Rolle in der frühen Fotografie
Kaliumbromid wurde auch bei der Herstellung von Silberbromid (AgBr) verwendet, einer lichtempfindlichen Verbindung, die der grundlegende Bestandteil von Schwarz-Weiß-Fotofilmen und -Papieren ist.
Die Abwägungen verstehen: Das Problem der Bromidtoxizität
Der Grund, warum KBr als Beruhigungsmittel wirkte, ist auch die Quelle seiner Gefahr. Das Verständnis dieses Kompromisses ist der Schlüssel zum Verständnis seiner Verschiebung der Anwendung.
Der Mechanismus der „Bromintoxikation“
Das Bromidion (Br−) ist chemisch dem Chloridion (Cl−) ähnlich, das für die Nervenfunktion unerlässlich ist. Bei Einnahme hoher Dosen kann Bromid im Körper Chlorid verdrängen und das Zentralnervensystem stören.
Diese chronische Vergiftung, bekannt als Bromintoxikation (Bromismus), kann eine Reihe neurologischer und psychologischer Symptome verursachen, darunter Depressionen, Verwirrtheit, Psychosen und Hautausschläge. Die lange Halbwertszeit von Bromid im Körper macht es leicht, sich bis zu toxischen Werten anzureichern.
Moderne Sicherheitsvorkehrungen
Aufgrund der Gefahr der Bromintoxikation wird KBr nicht mehr in der Humanmedizin eingesetzt. Im Labor gilt es für seinen vorgesehenen Zweck als Standardchemikalie, die relativ sicher ist, muss aber mit angemessener Sorgfalt gehandhabt werden. Die Einnahme sollte immer vermieden werden, und eine Standard-Persönliche Schutzausrüstung wie Handschuhe und Schutzbrille sollte getragen werden.
Die richtige Wahl für Ihr Ziel treffen
Ihre Sichtweise auf KBr hängt vollständig von Ihrem Ziel ab.
- Wenn Ihr Schwerpunkt auf analytischer Chemie liegt: Betrachten Sie KBr als ein grundlegendes und unverzichtbares Werkzeug zur Präparation fester Proben für die IR-Spektroskopie.
- Wenn Ihr Schwerpunkt auf der Synthese liegt: Betrachten Sie KBr hauptsächlich als eine stabile, kostengünstige und wasserlösliche Quelle für Bromidionen für wässrige Reaktionen.
- Wenn Ihr Schwerpunkt auf der Wissenschaftsgeschichte liegt: Erkennen Sie KBr als ein klassisches Beispiel dafür, wie sich die Verwendung einer Verbindung entwickelt, wenn unser Verständnis ihrer Eigenschaften und biologischen Risiken vertieft wird.
Letztendlich bedeutet das Verständnis von Kaliumbromid, zu sehen, wie die Geschichte einer einfachen Verbindung durch ihre einzigartigen chemischen und physikalischen Eigenschaften geformt wird.
Zusammenfassungstabelle:
| Eigenschaft/Anwendung | Details |
|---|---|
| Chemische Formel | KBr |
| Chemischer Name | Kaliumbromid |
| Schlüsseleigenschaft | Transparent für IR-Licht (4000–400 cm⁻¹) |
| Hauptverwendung | Probenvorbereitung für die IR-Spektroskopie |
| Physikalische Form | Weißer, kristalliner Feststoff |
| Löslichkeit | Gut löslich in Wasser |
| Historische Verwendungen | Beruhigungsmittel, Antikonvulsivum, Fotografie |
Steigern Sie die analytischen Fähigkeiten Ihres Labors mit KINTEK
KBr ist ein grundlegendes Werkzeug für die präzise Infrarotspektroskopie und ermöglicht eine genaue chemische Analyse. Bei KINTEK sind wir auf die Bereitstellung hochwertiger Laborgeräte und Verbrauchsmaterialien spezialisiert, einschließlich zuverlässiger KBr-Presslinge und -Pressen, um Ihre Forschungs- und Analyseanforderungen zu unterstützen.
Unsere Produkte sind darauf ausgelegt, Konsistenz, Klarheit und Genauigkeit bei Ihren spektroskopischen Anwendungen zu gewährleisten. Ob Sie in der Pharmazie, den Materialwissenschaften oder der akademischen Forschung tätig sind, KINTEK liefert die zuverlässigen Verbrauchsmaterialien, die Sie für hervorragende Ergebnisse benötigen.
Sind Sie bereit, Ihren IR-Spektroskopie-Workflow zu optimieren? Kontaktieren Sie noch heute unsere Experten, um Ihre spezifischen Anforderungen zu besprechen und herauszufinden, wie KINTEK den Erfolg Ihres Labors unterstützen kann.
Visuelle Anleitung
Ähnliche Produkte
- Elektrodenpolier-Material für elektrochemische Experimente
- Labor-Vortexmischer Orbitalschüttler Multifunktionaler Rotationsoszillationsmischer
- Leitfähiges Kohlenstofftuch, Kohlenstoffpapier, Kohlenstofffilz für Elektroden und Batterien
- Laborhydraulikpresse Labor-Pelletpresse für Knopfzellenbatterien
- Leitfähige Bornitrid-BN-Keramiken-Verbundwerkstoffe für fortschrittliche Anwendungen
Andere fragen auch
- Was ist der Zweck von Aluminiumoxid-Poliermittel bei der Vorbehandlung von GCE? Beherrschen Sie die Oberflächenvorbereitung für die Elektrochemie
- Was sind die Vorteile eines elektrolytischen Poliergeräts für TEM-Proben aus EK-181-Stahl? Gewährleistung der Integrität der Probe
- Was sind die zwei Methoden, die zur Verhinderung der Korrosion eines Metalls eingesetzt werden können? Barriere- vs. Opferanodenschutz erklärt
- Was ist die Bedeutung des elektrolytischen Polierens und der Elektrolysezellen bei der Probenvorbereitung von FeCrAl? Enthüllung echter Strukturen.
- Wie beeinflusst die Stichprobengröße die Analyse? Maximieren Sie die Zuverlässigkeit Ihrer Forschung



















