Im Wesentlichen ist der Quenching-Effekt jeder Prozess, der die Intensität und/oder Lebensdauer der Fluoreszenz einer bestimmten Substanz verringert. Dies geschieht, wenn ein angeregtes Fluorophor – ein Molekül, das Licht absorbieren und wieder emittieren kann – durch eine Wechselwirkung mit einem anderen Molekül, bekannt als Quencher, deaktiviert wird. Anstatt seine absorbierte Energie als Photon freizusetzen, kehrt das Fluorophor über einen nicht-strahlenden Weg in seinen Grundzustand zurück, wodurch sein Leuchten effektiv gedämpft oder gelöscht wird.
Das Kernprinzip ist, dass Quenching nicht einfach nur das Dimmen eines Signals ist; es ist eine spezifische molekulare Wechselwirkung. Zu verstehen, ob diese Wechselwirkung vor oder nach der Lichtabsorption stattfindet, ist der Schlüssel zur Unterscheidung ihrer primären Typen und zur Entscheidung, ob Quenching ein experimentelles Problem ist, das behoben werden muss, oder ein leistungsstarkes analytisches Werkzeug, das genutzt werden kann.

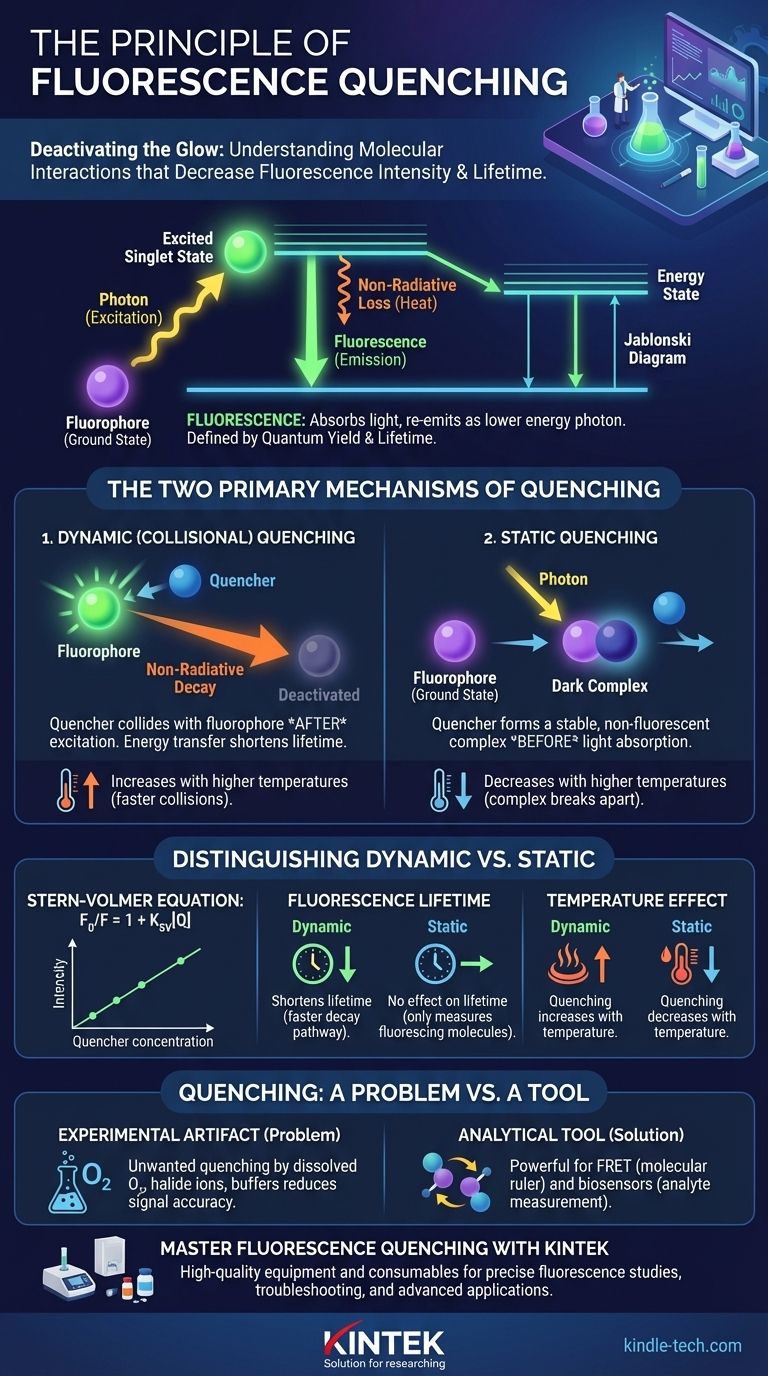
Die Grundlage: Wie Fluoreszenz funktioniert
Um Quenching zu verstehen, müssen Sie zuerst sein Gegenteil verstehen: Fluoreszenz. Dieses Phänomen ist ein mehrstufiger Prozess, der von den Energiezuständen eines Moleküls bestimmt wird.
Das Jablonski-Diagramm in Kürze
Ein vereinfachtes Jablonski-Diagramm hilft, den Prozess zu visualisieren. Zuerst absorbiert ein Fluorophor ein Photon Licht, wodurch ein Elektron in einen höheren Energie-, angeregten Singulettzustand befördert wird.
Dieser angeregte Zustand ist instabil. Das Molekül verliert schnell eine kleine Menge Energie als Wärme oder Vibration, bevor es die verbleibende Energie als Photon mit geringerer Energie (längere Wellenlänge) emittiert, das wir als Fluoreszenz sehen.
Fluoreszenzlebensdauer und Quantenausbeute
Zwei Eigenschaften definieren die Emission eines Fluorophors. Die Quantenausbeute ist die Effizienz dieses Prozesses – das Verhältnis der emittierten Photonen zu den absorbierten Photonen. Die Fluoreszenzlebensdauer ist die durchschnittliche Zeit, die das Fluorophor im angeregten Zustand verbringt, bevor es in den Grundzustand zurückkehrt, typischerweise in der Größenordnung von Nanosekunden. Quenching reduziert direkt beide Werte.
Die zwei primären Quenching-Mechanismen
Die Wechselwirkung zwischen einem Fluorophor und einem Quencher kann auf zwei grundlegend unterschiedliche Weisen erfolgen, die unterschiedliche experimentelle Signaturen aufweisen.
Dynamisches (kollisionelles) Quenching
Dynamisches Quenching tritt auf, wenn ein Quencher-Molekül mit einem Fluorophor kollidiert, nachdem es bereits durch Licht angeregt wurde. Während dieser Kollision wird Energie vom Fluorophor auf den Quencher übertragen.
Dieser Kontakt bietet einen externen, nicht-strahlenden Weg für das angeregte Fluorophor, in seinen Grundzustand zurückzukehren. Da es von zufälligen Kollisionen abhängt, ist dieser Prozess stark von Faktoren wie Temperatur und Viskosität abhängig, die die molekulare Diffusion beeinflussen.
Statisches Quenching
Statisches Quenching tritt auf, wenn ein Quencher-Molekül einen stabilen, nicht-fluoreszierenden Komplex mit einem Fluorophor bildet, bevor die Lichtabsorption stattfindet. Dieser Grundzustandskomplex ist effektiv "dunkel".
Wenn dieser Komplex ein Photon absorbiert, kehrt er sofort in den Grundzustand zurück, ohne Licht zu emittieren. Die beobachtete Abnahme der Fluoreszenz rührt daher, dass ein Teil der Fluorophore bereits gebunden und von vornherein nicht in der Lage war zu fluoreszieren.
Unterscheidung zwischen dynamischem und statischem Quenching
Für jedes Experiment ist die Bestimmung der Art des Quenchings entscheidend. Glücklicherweise haben sie unterschiedliche Auswirkungen auf die Eigenschaften des Fluorophors.
Die Stern-Volmer-Gleichung
Die Beziehung zwischen Fluoreszenzintensität und Quencherkonzentration wird durch die Stern-Volmer-Gleichung beschrieben: F₀/F = 1 + Kₛᵥ[Q].
Hier ist F₀ die Fluoreszenzintensität ohne Quencher, F ist die Intensität mit Quencher, [Q] ist die Konzentration des Quenchers und Kₛᵥ ist die Stern-Volmer-Quenching-Konstante. Eine lineare Darstellung von F₀/F versus [Q] ist ein Hinweis auf einen einzelnen Quenching-Mechanismus.
Der Einfluss auf die Fluoreszenzlebensdauer
Dies ist der entscheidende Test. Dynamisches Quenching verkürzt die gemessene Fluoreszenzlebensdauer, da es einen schnelleren Weg für das angeregte Fluorophor einführt, in den Grundzustand zurückzukehren.
Umgekehrt hat statisches Quenching keinen Einfluss auf die Fluoreszenzlebensdauer. Die Fluorophore, die nicht Teil des Grundzustandskomplexes sind, fluoreszieren normal, und die "gequenchten" Moleküle wurden von vornherein nie angeregt. Die Lebensdauermessung erfasst nur das Signal der Moleküle, die noch fluoreszieren können.
Der Einfluss der Temperatur
Die Temperatur ist ein weiteres leistungsstarkes Diagnosewerkzeug. Da dynamisches Quenching auf Kollisionen beruht, erhöht sich seine Rate mit höheren Temperaturen, die dazu führen, dass sich Moleküle schneller bewegen und diffundieren.
Statisches Quenching hingegen beruht auf einem stabilen Komplex. Höhere Temperaturen liefern oft genug Energie, um diesen Komplex aufzubrechen, wodurch die Menge des statischen Quenchings abnimmt.
Quenching: Ein Problem vs. ein Werkzeug
Quenching ist ein zweischneidiges Schwert in der wissenschaftlichen Forschung. Je nach Kontext kann es eine frustrierende Fehlerquelle oder eine hochpräzise Messtechnik sein.
Quenching als experimentelles Artefakt
Unerwünschtes Quenching ist ein häufiges Problem. Häufige Übeltäter in biologischen Proben sind gelöster Sauerstoff, Halogenidionen (wie Cl⁻ oder I⁻) und bestimmte Pufferkomponenten. Dies kann zu einem reduzierten Signal-Rausch-Verhältnis und ungenauen Messungen führen.
Quenching als analytisches Werkzeug
Kontrolliert eingesetzt, ist Quenching unglaublich leistungsstark. Förster-Resonanzenergietransfer (FRET) ist eine spezielle Art des Quenchings, bei der Energie zwischen zwei verschiedenen Fluorophoren übertragen wird, wodurch Forscher molekulare Abstände im Nanometerbereich messen können.
Darüber hinaus sind Quenching-basierte Biosensoren so konzipiert, dass das Vorhandensein eines spezifischen Analyten (wie Glukose oder Sauerstoff) ein Fluoreszenzsignal quenchert. Der Grad des Quenchings wird zu einem direkten Ablesewert der Konzentration des Analyten.
Dieses Wissen auf Ihr Experiment anwenden
Ihr Ansatz zum Quenching hängt vollständig von Ihrem experimentellen Ziel ab.
- Wenn Ihr Hauptaugenmerk auf der Maximierung eines Fluoreszenzsignals liegt: Überprüfen Sie Ihre Lösungen auf häufige Quencher (z. B. Acrylamid, Iodid, gelöstes O₂) und erwägen Sie das Entgasen von Proben oder die Verwendung anderer Puffer.
- Wenn Ihr Hauptaugenmerk auf der Messung der Analytkonzentration liegt: Entwerfen Sie ein System, bei dem Ihr Zielanalyt der Quencher ist, sodass Sie dessen Konzentration durch Messung des vorhersagbaren Abfalls der Fluoreszenz berechnen können.
- Wenn Ihr Hauptaugenmerk auf der Untersuchung molekularer Wechselwirkungen liegt: Setzen Sie kontrollierte Quenching-Techniken wie FRET ein, bei denen das Quenching eines "Donor"-Fluorophors durch einen "Akzeptor" ein direktes Maß für deren Nähe liefert.
Indem Sie die Prinzipien des Quenchings verstehen, verwandeln Sie es von einem potenziellen Hindernis in ein präzises Instrument für die molekulare Untersuchung.
Zusammenfassungstabelle:
| Quenching-Typ | Mechanismus | Auswirkung auf die Lebensdauer | Temperaturabhängigkeit |
|---|---|---|---|
| Dynamisch (kollisionell) | Quencher kollidiert mit angeregtem Fluorophor | Verkürzt die Lebensdauer | Steigt mit der Temperatur |
| Statisch | Bildet einen nicht-fluoreszierenden Komplex vor der Anregung | Keine Auswirkung auf die Lebensdauer | Nimmt mit der Temperatur ab |
Bereit, Fluoreszenz-Quenching in Ihrem Labor zu meistern? KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien, einschließlich Fluorometer, Quencher und Reagenzien, die für präzise Fluoreszenzstudien unerlässlich sind. Egal, ob Sie unerwünschtes Quenching beheben oder fortschrittliche Biosensoren entwickeln, unsere Lösungen gewährleisten genaue, zuverlässige Ergebnisse. Kontaktieren Sie noch heute unsere Experten, um Ihre Fluoreszenzexperimente zu optimieren!
Visuelle Anleitung
Ähnliche Produkte
- Beheizte Hydraulische Pressmaschine mit integrierten manuellen Heizplatten für den Laboreinsatz
- Manuelle Labor-Heizpresse
- 30T 40T Split Automatische Beheizte Hydraulische Pressmaschine mit Heizplatten für Labor-Heißpresse
- Laborhydraulische Pelletpresse für XRF KBR FTIR Laboranwendungen
- 24T 30T 60T Beheizbare Hydraulische Pressmaschine mit Heizplatten für Labor-Heißpressen
Andere fragen auch
- Was ist ein Magnetronsputter-System? Erzielen Sie eine überlegene Dünnschichtabscheidung für Ihr Labor
- Was ist der Unterschied zwischen traditionellem Sintern und selektivem Lasersintern? Wählen Sie den richtigen Fertigungsweg
- Was sind die Vorteile des reaktiven Sputterns? Erzielen Sie präzise Kontrolle über Verbunddünnschichten
- Was sind die Gefahren beim Wärmebehandlungsprozess? Minderung thermischer, chemischer und mechanischer Risiken
- Wie nennt man einen wissenschaftlichen Mischer? Den richtigen Mischer für Ihr Labor auswählen
- Beeinflusst Druck das Schmelzen und Sieden? Beherrschen Sie Phasenübergänge mit Druckkontrolle
- Was sind die Stärken des Hartlötens? Erreichen Sie eine starke, saubere und präzise Metallverbindung
- Was ist vorbeugende Wartung von Anlagen? Der Wandel vom reaktiven Chaos zur proaktiven Kontrolle














