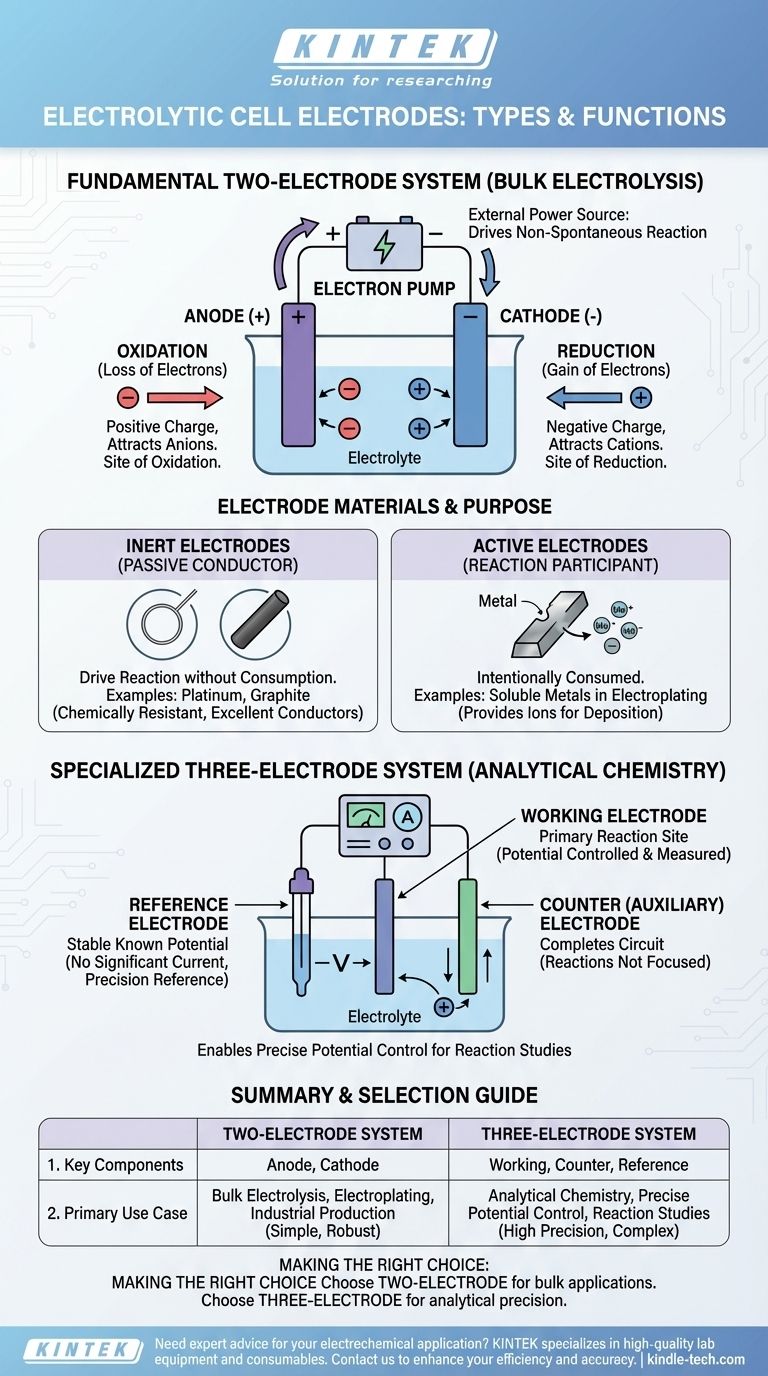
Im Kern verwendet eine Elektrolysezelle zwei primäre Elektroden: eine positiv geladene Anode, an der Oxidation stattfindet, und eine negativ geladene Kathode, an der Reduktion stattfindet. Für präzisere analytische Arbeiten wird ein Drei-Elektroden-System verwendet, das aus einer Arbeitselektrode, einer Gegenelektrode und einer Referenzelektrode besteht.
Die Art und Anzahl der in einer Elektrolysezelle verwendeten Elektroden wird durch ihren Zweck bestimmt. Ein einfacher Zwei-Elektroden-Aufbau (Anode und Kathode) reicht aus, um eine chemische Reaktion anzutreiben, während ein Drei-Elektroden-System notwendig ist, um diese präzise zu messen und zu steuern.

Das grundlegende Zwei-Elektroden-System
Die meisten Elektrolysezellen, von Demonstrationen im Klassenzimmer bis hin zur industriellen Produktion, basieren auf einem Zwei-Elektroden-Fundament. Dieses System verwendet eine externe Stromquelle, um eine nicht-spontane chemische Reaktion zu erzwingen.
Die Anode: Ort der Oxidation
Die Anode ist die Elektrode, die mit dem positiven Pol der Stromquelle verbunden ist. Aufgrund ihrer positiven Ladung zieht sie negativ geladene Ionen (Anionen) aus der Elektrolytlösung an. An der Oberfläche der Anode verlieren diese Ionen Elektronen in einem Prozess, der als Oxidation bezeichnet wird.
Die Kathode: Ort der Reduktion
Umgekehrt ist die Kathode mit dem negativen Pol der Stromversorgung verbunden. Ihre negative Ladung zieht positiv geladene Ionen (Kationen) an. An der Oberfläche der Kathode nehmen diese Ionen Elektronen in einem Prozess auf, der als Reduktion bekannt ist.
Die Rolle der externen Stromquelle
Im Gegensatz zu einer Batterie (einer galvanischen Zelle), die Spannung erzeugt, verbraucht eine Elektrolysezelle diese. Die Stromquelle fungiert als "Elektronenpumpe", die Elektronen von der Anode abzieht und zur Kathode drückt, wodurch die Ladung aufgezwungen und der gesamte Prozess angetrieben wird.
Elektrodenmaterialien und ihr Zweck
Das Material, aus dem eine Elektrode besteht, ist entscheidend für die Funktion der Zelle. Die Wahl hängt davon ab, ob die Elektrode ein aktiver Teilnehmer oder ein passiver Beobachter der Reaktion sein soll.
Inerte Elektroden: Der passive Leiter
In vielen Anwendungen besteht das Ziel darin, eine Reaktion innerhalb des Elektrolyten anzutreiben, ohne dass die Elektrode selbst verbraucht wird. In diesen Fällen werden inerte Elektroden verwendet. Materialien wie Platin und Graphit (eine Form von Kohlenstoff) sind gängige Wahlmöglichkeiten, da sie ausgezeichnete elektrische Leiter, aber chemisch beständig und unwahrscheinlich reaktiv sind.
Aktive Elektroden: Der Reaktionsteilnehmer
Bei einigen Prozessen, wie der Galvanisierung oder Raffination, ist die Anode absichtlich so konstruiert, dass sie verbraucht wird. Eine aktive Elektrode besteht aus einem Material, das oxidiert und sich im Elektrolyten löst, wodurch die Metallionen bereitgestellt werden, die später auf der Kathode abgeschieden werden.
Das spezialisierte Drei-Elektroden-System
Für die analytische Chemie, wo das Ziel darin besteht, eine Reaktion zu untersuchen, anstatt eine Massenelektrolyse durchzuführen, ist ein ausgefeilteres Drei-Elektroden-System erforderlich. Dieser Aufbau ermöglicht eine extrem präzise Steuerung des Elektrodenpotenzials.
Die Arbeitselektrode
Dies ist die primäre Elektrode, an der die interessierende Reaktion stattfindet. Ihr elektrisches Potenzial ist die Variable, die sorgfältig kontrolliert und gemessen wird.
Die Gegen- (oder Hilfs-) Elektrode
Der einzige Zweck der Gegenelektrode besteht darin, den Stromkreis zu schließen. Strom fließt zwischen der Arbeitselektrode und der Gegenelektrode, aber die an der Gegenelektrode ablaufenden Reaktionen stehen nicht im Mittelpunkt des Experiments.
Die Referenzelektrode
Dies ist der Schlüssel zur Präzision des Systems. Eine Referenzelektrode liefert ein stabiles, bekanntes elektrisches Potenzial. Es fließt kein signifikanter Strom durch sie, sodass ihr Potenzial konstant bleibt. Durch die Messung des Potenzials der Arbeitselektrode gegen diese stabile Referenz kann ein Forscher deren Spannung mit hoher Genauigkeit kennen und steuern.
Die Kompromisse verstehen
Die Wahl eines Systems beinhaltet das Abwägen von Einfachheit und der Notwendigkeit der Kontrolle.
Das Zwei-Elektroden-System: Einfachheit für die Produktion
Dieser Aufbau ist einfach, robust und ideal für großtechnische Anwendungen wie die Herstellung von Chlorgas oder Aluminium. Seine Einschränkung ist ein Mangel an präziser Potenzialkontrolle, da die angelegte Spannung unvorhersehbar zwischen den beiden Elektroden und dem Elektrolyten aufgeteilt wird.
Das Drei-Elektroden-System: Präzision für die Analyse
Dieses System bietet eine exquisite Kontrolle, die für die Untersuchung von Reaktionsmechanismen und die Durchführung empfindlicher elektrochemischer Analysen unerlässlich ist. Es ist jedoch komplexer und wird im Allgemeinen für Laborarbeiten mit geringem Strom, nicht für die industrielle Produktion, verwendet.
Die richtige Wahl für Ihr Ziel treffen
Ihr Ziel bestimmt die notwendige Elektrodenkonfiguration.
- Wenn Ihr Hauptaugenmerk auf der Massenelektrolyse oder einer einfachen Demonstration (z. B. Wasserspaltung, Galvanisierung) liegt: Ein Zwei-Elektroden-System (Anode und Kathode) aus geeigneten Materialien ist die richtige und effizienteste Wahl.
- Wenn Ihr Hauptaugenmerk auf der analytischen Messung oder der Untersuchung eines Reaktionsmechanismus liegt: Ein Drei-Elektroden-System (Arbeits-, Gegen-, Referenzelektrode) ist für die erforderliche Präzision und Kontrolle unerlässlich.
Letztendlich befähigt Sie das Verständnis der Funktion jeder Elektrode, die richtigen Werkzeuge für die anstehende chemische Aufgabe auszuwählen.
Zusammenfassungstabelle:
| Elektrodensystem | Schlüsselkomponenten | Primärer Anwendungsfall |
|---|---|---|
| Zwei-Elektroden | Anode (Oxidation), Kathode (Reduktion) | Massenelektrolyse, Galvanisierung, Industrielle Produktion |
| Drei-Elektroden | Arbeits-, Gegen-, Referenzelektroden | Analytische Chemie, Präzise Potenzialkontrolle, Reaktionsstudien |
Benötigen Sie Expertenrat bei der Auswahl der richtigen Elektroden für Ihre elektrochemische Anwendung? KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien für alle Ihre Laborbedürfnisse. Egal, ob Sie sich auf die industrielle Produktion oder präzise analytische Arbeiten vorbereiten, unser Team kann Ihnen helfen, das optimale System zur Steigerung Ihrer Effizienz und Genauigkeit auszuwählen. Kontaktieren Sie uns noch heute, um Ihre spezifischen Anforderungen zu besprechen!
Visuelle Anleitung
Ähnliche Produkte
- Kupfersulfat-Referenzelektrode für Laboranwendungen
- Platinblechelektrode für Labor- und Industrieanwendungen
- Platinblechelektrode für Laboranwendungen in der Batterieforschung
- Multifunktionale Elektrolysezellen-Wasserbäder, einlagig, doppelwandig
- Aluminiumfolien-Stromabnehmer für Lithiumbatterien
Andere fragen auch
- Was sind die Vor- und Nachteile der Kupfersulfat-Referenzelektrode mit Holzstopfen? Geschwindigkeit vs. Haltbarkeit erklärt
- Wie sollte eine Kupfersulfat-Referenzelektrode gewartet werden? Sicherstellung genauer elektrochemischer Messungen
- Wie sollte eine Kupfersulfat-Bezugselektrode gelagert werden? Ein Leitfaden zur kurz- und langfristigen Lagerung
- Was ist das Funktionsprinzip einer Kupfer(II)-sulfat-Referenzelektrode? Zuverlässige Potenzialmessung erklärt
- Was sind die Vor- und Nachteile der Kupfersulfat-Referenzelektrode mit Keramikkern?