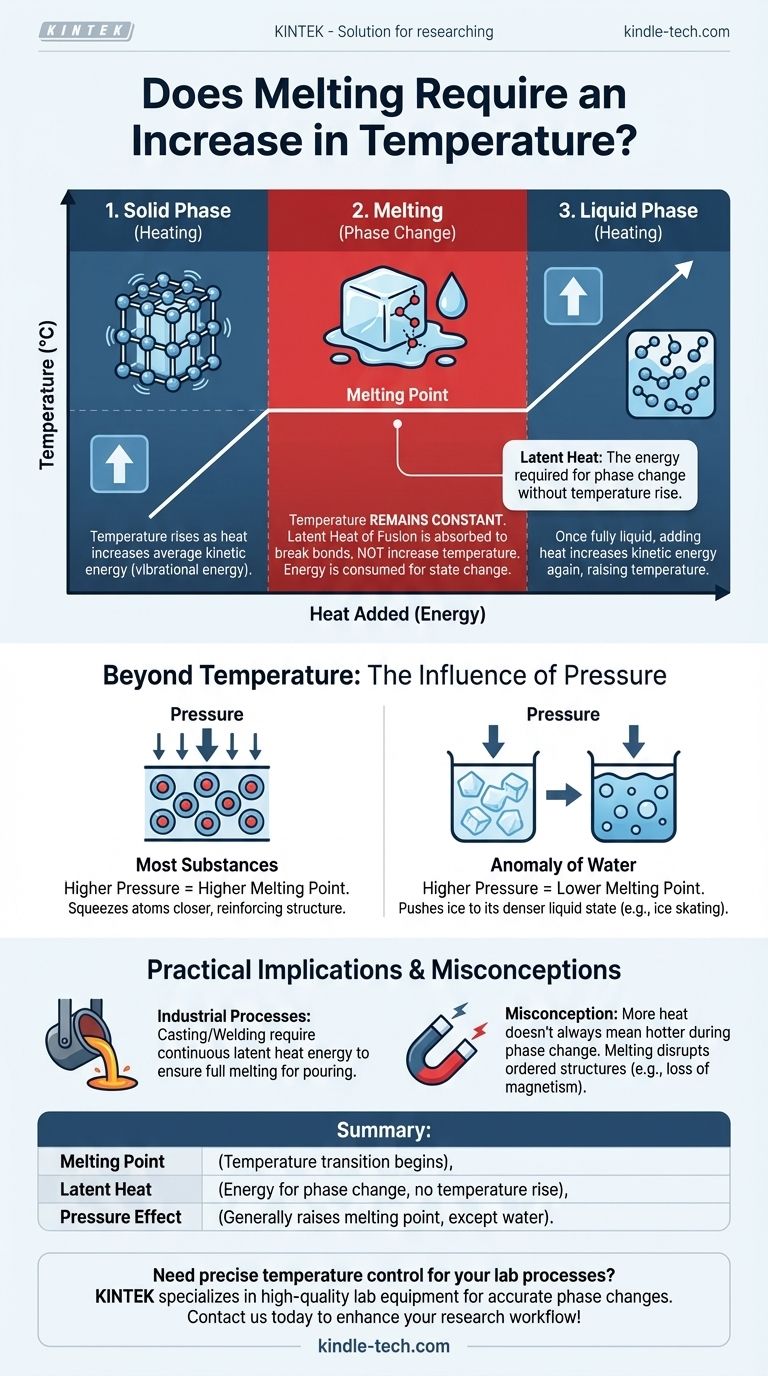
Die Beziehung zwischen Wärme, Temperatur und Schmelzen wird oft missverstanden. Um einen Feststoff zu schmelzen, muss Energie in Form von Wärme zugeführt werden. Dieser Prozess erhöht zunächst die Temperatur der Substanz, bis sie ihren spezifischen Schmelzpunkt erreicht. Während des eigentlichen Übergangs vom festen in den flüssigen Zustand bleibt die Temperatur jedoch konstant, selbst wenn weitere Wärme zugeführt wird.
Während eine Substanz zuerst auf ihren Schmelzpunkt erhitzt werden muss, findet der Schmelzprozess selbst bei konstanter Temperatur statt. Die zugeführte Energie, bekannt als latente Wärme, wird verwendet, um die Bindungen der festen Struktur aufzubrechen, nicht um die Gesamttemperatur der Substanz zu erhöhen.

Die Physik eines Phasenübergangs
Um zu verstehen, warum Schmelzen bei konstanter Temperatur stattfindet, müssen wir zunächst zwischen Wärme und Temperatur unterscheiden. Sie sind verwandt, aber nicht dasselbe.
Was ist Temperatur?
Temperatur ist ein Maß für die durchschnittliche kinetische Energie der Atome oder Moleküle innerhalb einer Substanz. In einem Feststoff sind diese Atome in einer festen Struktur, wie einem Kristallgitter, eingeschlossen, aber sie vibrieren ständig. Wenn Sie Wärme hinzufügen, erhöhen Sie diese Vibrationsenergie, die wir als Temperaturanstieg messen.
Erreichen des Schmelzpunkts
Wenn Sie weiterhin Wärme hinzufügen, vibrieren die Atome immer heftiger. Schließlich erreichen sie ein Energieniveau, bei dem die Vibrationen stark genug sind, um die starren Bindungen, die sie in ihren festen Positionen halten, aufzubrechen. Diese spezifische Temperatur ist der Schmelzpunkt.
Die Rolle der latenten Wärme
Am Schmelzpunkt tritt eine kritische Veränderung ein. Jede zusätzliche Wärmeenergie, die Sie zuführen – bekannt als latente Schmelzwärme – wird nun ausschließlich dazu verwendet, die verbleibenden Bindungen der festen Struktur aufzubrechen. Sie wird nicht dazu verwendet, die Moleküle schneller vibrieren zu lassen.
Da die Energie verbraucht wird, um den Zustand der Substanz (von fest zu flüssig) zu ändern, anstatt ihre kinetische Energie zu erhöhen, bleibt die Temperatur perfekt konstant, bis der gesamte Feststoff zu einer Flüssigkeit geworden ist.
Der flüssige Zustand
Sobald der letzte Rest des Feststoffs geschmolzen ist, befindet sich die Substanz vollständig im flüssigen Zustand. Von diesem Zeitpunkt an wird jede weitere Wärme, die Sie hinzufügen, die kinetische Energie der Moleküle wieder erhöhen, wodurch die Temperatur der Flüssigkeit ansteigt.
Jenseits der Temperatur: Der Einfluss des Drucks
Temperatur ist nicht der einzige Faktor, der das Schmelzen steuert. Druck spielt eine entscheidende und manchmal kontraintuitive Rolle.
Wie Druck das Schmelzen beeinflusst
Bei den meisten Substanzen erhöht ein Anstieg des äußeren Drucks den Schmelzpunkt. Hoher Druck drückt die Atome physisch näher zusammen und verstärkt die feste Struktur. Dies bedeutet, dass mehr Energie (und somit eine höhere Temperatur) erforderlich ist, um die Bindungen aufzubrechen und die Substanz schmelzen zu lassen.
Die Anomalie des Wassers
Wasser ist eine bemerkenswerte Ausnahme. Die feste Form von Wasser (Eis) ist weniger dicht als ihre flüssige Form. Ein erhöhter Druck auf Eis drängt es in seinen dichteren Zustand – flüssiges Wasser. Dies bedeutet, dass Eis unter hohem Druck bei einer Temperatur unter seinem Standard-Schmelzpunkt von 0°C (32°F) schmelzen kann. Dieses Prinzip trägt dazu bei, wie die Kufe eines Schlittschuhs über Eis gleitet.
Praktische Implikationen und Missverständnisse
Das Verständnis dieses Prozesses ist nicht nur akademisch; es hat direkte Konsequenzen in Wissenschaft und Technik.
Missverständnis: Mehr Wärme bedeutet immer heißer
Das häufigste Missverständnis ist, dass kontinuierliches Hinzufügen von Wärme etwas immer heißer macht. Während eines Phasenübergangs, wie Schmelzen oder Sieden, ist dies falsch. Die Energiezufuhr bewirkt die Zustandsänderung des Materials, nicht die Erhöhung seiner Temperatur.
Warum dies in der Praxis wichtig ist
In industriellen Prozessen wie dem Gießen oder Schweißen von Metallen ist dieses Prinzip entscheidend. Ein Ofen muss ein Metall nicht nur auf seinen Schmelzpunkt bringen, sondern auch eine erhebliche und kontinuierliche Menge zusätzlicher Energie (die latente Wärme) zuführen, um sicherzustellen, dass die gesamte Masse für das Gießen vollständig flüssig wird. Ebenso stört das Schmelzen die geordnete atomare Struktur von Materialien. Aus diesem Grund führt das Erhitzen eines magnetisierten Stahlstücks über einen bestimmten Punkt (seine Curie-Temperatur, die mit dem Schmelzpunkt verwandt, aber davon verschieden ist) dazu, dass es seinen Magnetismus verliert, da die organisierten magnetischen Domänen aufgebrochen werden.
Die richtige Wahl für Ihr Ziel treffen
Ihre Anwendung bestimmt, welcher Teil dieses Prozesses für Sie am wichtigsten ist.
- Wenn Ihr Hauptaugenmerk auf dem Verständnis der grundlegenden Physik liegt: Denken Sie daran, dass die Temperatur während eines Phasenübergangs konstant ist; die zugeführte Energie wird latente Wärme genannt und dient der Zustandsänderung.
- Wenn Ihr Hauptaugenmerk auf Materialwissenschaft oder Ingenieurwesen liegt: Erkennen Sie, dass das vollständige Schmelzen einer Substanz eine präzise und kontinuierliche Energiezufuhr erfordert, selbst nachdem sie ihre Schmelztemperatur erreicht hat.
- Wenn Sie Umwelteinflüsse berücksichtigen: Beachten Sie, dass Druck den Schmelzpunkt einer Substanz erheblich verändern kann, ihn für die meisten Materialien erhöht, aber für eine wichtige Ausnahme wie Wasser senkt.
Das Verständnis dieser Unterscheidung zwischen Temperatur und Wärmeenergie ist grundlegend für die Kontrolle und Vorhersage des Verhaltens jedes Materials.
Zusammenfassungstabelle:
| Konzept | Beschreibung |
|---|---|
| Schmelzpunkt | Temperatur, bei der ein Feststoff beginnt, in Flüssigkeit überzugehen. |
| Latente Schmelzwärme | Energie, die während des Schmelzens ohne Temperaturänderung absorbiert wird. |
| Druckeffekt | Hoher Druck erhöht den Schmelzpunkt (außer bei Wasser, wo er ihn senkt). |
| Praktische Anwendung | Entscheidend für industrielle Prozesse wie Metallguss und Schweißen. |
Benötigen Sie präzise Temperaturkontrolle für Ihre Laborprozesse? KINTEK ist spezialisiert auf hochwertige Laborgeräte, einschließlich Öfen und Heizsysteme, die für Phasenübergänge wie das Schmelzen mit Genauigkeit ausgelegt sind. Ob Sie mit Metallen, Polymeren oder anderen Materialien arbeiten, unsere Lösungen gewährleisten ein effizientes Energiemanagement und konsistente Ergebnisse. Kontaktieren Sie uns noch heute, um zu erfahren, wie unsere Laborgeräte Ihre Forschung oder Ihren Produktionsablauf verbessern können!
Visuelle Anleitung
Ähnliche Produkte
- Labor-Muffelofen-Bodenhub-Muffelofen
- 1800℃ Muffelofen für Labor
- 1700℃ Muffelofen für Labor
- 1400℃ Muffelofen für Labor
- 1400℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
Andere fragen auch
- Was ist isostatisches Pressen, heiß und kalt? Formgebung vs. Endbearbeitung für überlegene Materialien
- Was ist vorbeugende Wartung in einem Labor? Eine proaktive Strategie für Laborzuverlässigkeit und Datenintegrität
- Was sind die Toxizitäts- und Sicherheitsprobleme von Kohlenstoffnanoröhren? Die physikalischen Risiken von Nanomaterialien verstehen
- Was sind die physikalischen Eigenschaften von Stickstoffgas? Ein Leitfaden zu seiner Kraft und unsichtbaren Gefahren
- Was ist der Strom eines Sputterions? Kontrollieren Sie Ihre Abscheiderate und -qualität für dünne Schichten
- Wie wirken sich Nanoröhrchen auf die Umwelt aus? Abwägung zwischen geringem CO2-Fußabdruck und ökologischen Risiken
- Was sind die Vorteile der Elektronenstrahlmethode? Erreichen Sie Geschwindigkeit, Kosteneinsparungen und Materialintegrität
- Warum wird Aluminiumoxid bei der SHS-Chrom-Aluminisierung hinzugefügt? Optimierung der Verbrennung & Beschichtungsstabilität



















