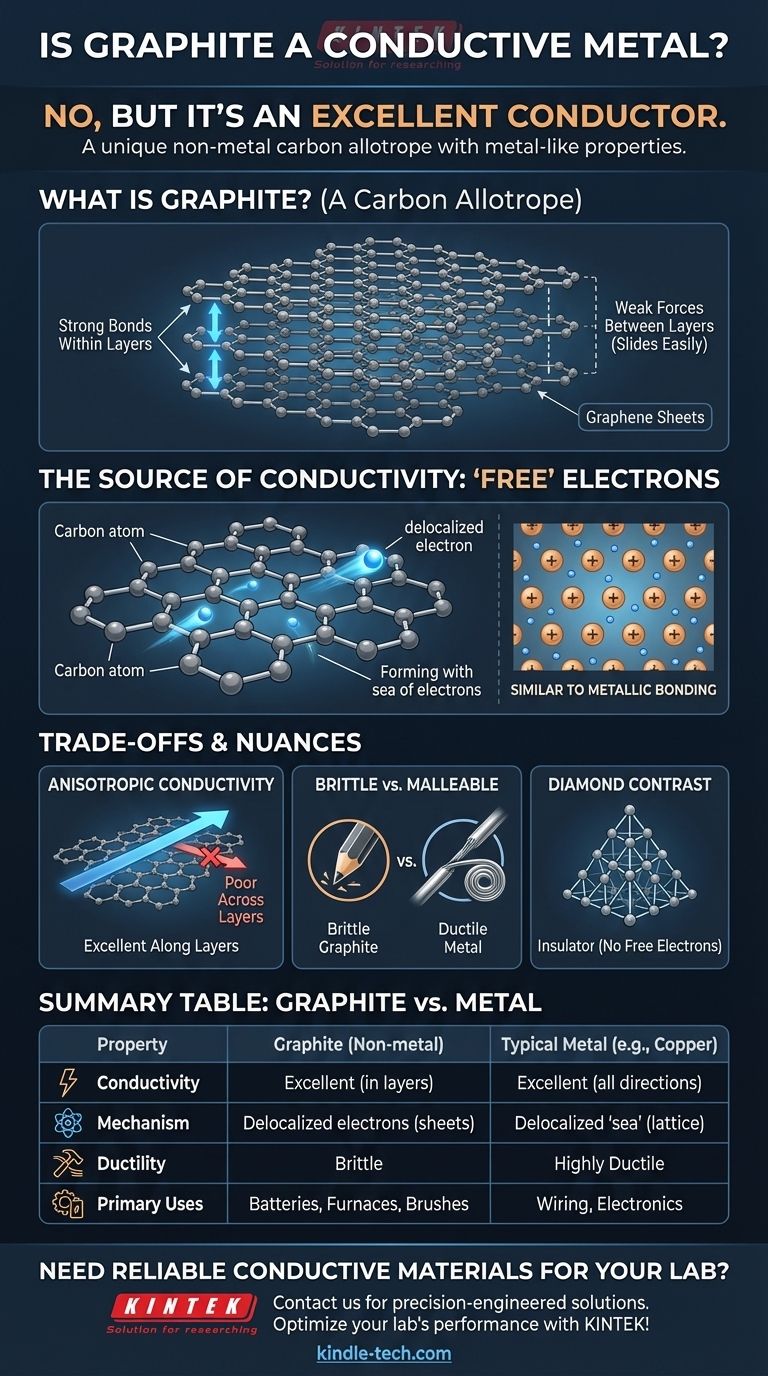
Nein, Graphit ist kein Metall, aber es ist ein ausgezeichneter elektrischer Leiter. Diese Unterscheidung führt häufig zu Verwirrung, da uns oft beigebracht wird, Leitfähigkeit ausschließlich mit metallischen Elementen in Verbindung zu bringen. Graphit ist ein Allotrop – eine spezifische strukturelle Form – des Nichtmetalls Kohlenstoff.
Der Hauptgrund für diese Verwirrung liegt darin, dass wir Materialien dazu neigen, sie nach einfachen Kategorien anstatt nach ihrer grundlegenden Struktur zu gruppieren. Graphit leitet zwar Elektrizität, obwohl es ein Nichtmetall ist, weil seine einzigartige geschichtete atomare Anordnung „freie“ Elektronen erzeugt, die sich fast genau wie die Elektronen in einem echten Metall verhalten.

Was ist Graphit? Eine einzigartige Form von Kohlenstoff
Die Eigenschaften von Graphit ergeben sich direkt aus seiner einzigartigen Atomstruktur. Das Verständnis dieser Struktur ist der Schlüssel zum Verständnis seines Verhaltens.
Kein Metall, aber ein Allotrop
Elemente können in verschiedenen physikalischen Formen existieren, die als Allotrope bezeichnet werden. Diese Formen bestehen aus denselben Atomen, weisen jedoch unterschiedliche strukturelle Anordnungen auf, was ihnen sehr unterschiedliche Eigenschaften verleiht.
Graphit ist ein Allotrop des Kohlenstoffs. Das berühmteste andere Allotrop des Kohlenstoffs ist der Diamant. Obwohl beide reiner Kohlenstoff sind, führen ihre Strukturen dazu, dass Graphit ein weicher Leiter und Diamant ein harter Isolator ist.
Eine Struktur aus gestapelten Schichten
Graphit besteht aus unzähligen flachen Schichten, die übereinander gestapelt sind. Jede Schicht, bekannt als Graphen, ist eine ein Atom dicke Schicht von Kohlenstoffatomen, die in einem bienenwabenartigen hexagonalen Gitter angeordnet sind.
Die Bindungen, die die Atome innerhalb einer Schicht zusammenhalten, sind unglaublich stark. Die Kräfte, die die verschiedenen Schichten miteinander zusammenhalten, sind jedoch sehr schwach, wodurch sie leicht auseinandergleiten können. Deshalb ist Graphit weich und schuppig und bildet die „Mine“ in Bleistiften.
Die Quelle der Leitfähigkeit von Graphit
Der Grund, warum Graphit Elektrizität leitet, liegt darin, wie seine Elektronen geteilt – oder besser gesagt, nicht geteilt – werden. Dies ahmt den Leitungsmechanismus von Metallen nach, ohne dass Graphit selbst ein Metall ist.
Die Rolle der Elektronen des Kohlenstoffs
Jedes Kohlenstoffatom verfügt über vier äußere Elektronen (Valenzelektronen), die für die Bindung zur Verfügung stehen. In der hexagonalen Struktur einer Graphenschicht bildet jedes Kohlenstoffatom starke kovalente Bindungen mit drei benachbarten Atomen.
Das „freie“ delokalisierte Elektron
Dadurch bleibt eines der vier Valenzelektronen unberücksichtigt. Dieses vierte Elektron ist nicht in einer Bindung zwischen zwei bestimmten Atomen eingeschlossen. Stattdessen wird es delokalisiert und kann sich frei entlang seiner zweidimensionalen Graphenschicht bewegen.
Ein „Elektronenmeer“ in einem Nichtmetall
Diese Ansammlung delokalisierter Elektronen bildet ein mobiles „Elektronenmeer“ innerhalb jeder Schicht. Da ein elektrischer Strom lediglich der Fluss von Elektronen ist, ermöglichen diese frei beweglichen Elektronen dem Graphit, Elektrizität problemlos zu leiten.
Dies ist im Grunde ähnlich der metallischen Bindung, bei der ein Gitter positiver Metallionen in einem „Meer“ gemeinsamer, delokalisierter Elektronen sitzt. Graphit erreicht ein ähnliches Ergebnis mit einer völlig anderen Atomstruktur.
Verständnis der Kompromisse und Nuancen
Obwohl Graphit ein Leiter ist, ist es kein perfekter Ersatz für Metalle. Seine nichtmetallische Natur bringt deutliche Kompromisse mit sich.
Die Leitfähigkeit ist nicht einheitlich
Graphit ist stark anisotrop, was bedeutet, dass seine Eigenschaften richtungsabhängig sind. Es leitet Elektrizität extrem gut entlang seiner Graphenschichten, aber sehr schlecht über sie hinweg. Die meisten Metalle hingegen sind isotrop und leiten Elektrizität in alle Richtungen gleich gut.
Sprödigkeit vs. Duktilität
Metalle sind typischerweise duktil und formbar, was bedeutet, dass sie ohne Bruch zu Drähten gezogen oder in neue Formen gehämmert werden können. Graphit ist spröde und zerbricht unter ähnlicher Belastung. Man kann keinen Graphitdraht herstellen, indem man ihn zieht.
Diamant: Das isolierende Gegenstück
Diamant bietet den perfekten Kontrast. In seinem starren, tetraedrischen Gitter bindet jedes Kohlenstoffatom an vier andere und verbraucht dabei alle vier Valenzelektronen. Da keine delokalisierten Elektronen vorhanden sind, gibt es nichts, was sich frei bewegen und einen Strom transportieren könnte, was Diamant zu einem ausgezeichneten elektrischen Isolator macht.
Die richtige Wahl für Ihre Anwendung treffen
Das Verständnis dieser Prinzipien ermöglicht es Ihnen, das richtige Material basierend auf den spezifischen Eigenschaften auszuwählen, die für eine Aufgabe erforderlich sind.
- Wenn Ihr Hauptaugenmerk auf flexibler, omnidirektionaler Leitfähigkeit liegt: Metalle wie Kupfer und Aluminium bleiben aufgrund ihrer Duktilität und isotropen Natur die überlegene Wahl.
- Wenn Ihr Hauptaugenmerk auf einem leichten, chemisch stabilen Leiter für hohe Temperaturen liegt: Graphit ist ein ideales Material für Anwendungen wie Batterieelektroden, Ofenauskleidungen und elektrische Motorkohlen.
- Wenn Ihr Hauptaugenmerk auf Härte und elektrischer Isolierung liegt: Diamant, das andere berühmte Allotrop des Kohlenstoffs, ist die Lösung und beweist, dass die atomare Anordnung alles bestimmt.
Letztendlich werden die Eigenschaften eines Materials durch seine Atomstruktur definiert, nicht durch die einfache Kategorie, in die wir es einordnen.
Zusammenfassungstabelle:
| Eigenschaft | Graphit | Typisches Metall (z. B. Kupfer) |
|---|---|---|
| Materialtyp | Nichtmetall (Kohlenstoff-Allotrop) | Metall |
| Elektrische Leitfähigkeit | Ausgezeichnet (innerhalb der Schichten) | Ausgezeichnet (in alle Richtungen) |
| Leitungsmechanismus | Delokalisierte Elektronen in Graphenschichten | Delokalisiertes „Meer von Elektronen“ |
| Duktilität/Formbarkeit | Spröde, kann nicht zu Drähten gezogen werden | Hochgradig duktil und formbar |
| Hauptanwendungsfälle | Batterien, Ofenauskleidungen, Motorkohlen | Verkabelung, Strukturkomponenten, Elektronik |
Benötigen Sie ein zuverlässiges leitfähiges Material für Ihre Laboranwendung? Ob Sie mit Hochtemperaturofen, Batterieforschung oder kundenspezifischen Elektrodenaufbauten arbeiten, die Expertise von KINTEK im Bereich Laborgeräte und Verbrauchsmaterialien stellt sicher, dass Sie die richtige Lösung erhalten. Unser Team hilft Ihnen bei der Auswahl von Materialien, die Ihren spezifischen Anforderungen an Leitfähigkeit, Temperatur und Haltbarkeit entsprechen. Kontaktieren Sie uns noch heute, um die Leistung Ihres Labors mit präzisionsgefertigten Lösungen von KINTEK zu optimieren!
Visuelle Anleitung
Ähnliche Produkte
- Graphit-Scheiben-Stab- und Plattenelektrode Elektrochemische Graphitelektrode
- Isostatisch gepresste Graphit-Kohlenstoffplatte
- Vertikaler Hochtemperatur-Graphit-Vakuum-Graphitierungs-Ofen
- Großer vertikaler Graphit-Vakuumgraphitierungs-Ofen
- Graphit-Vakuum-Durchlaufgraphitierungsöfen
Andere fragen auch
- Warum wird ein hochreiner Graphitstab als Gegenelektrode bevorzugt? Gewährleistung einer unbelasteten elektrochemischen Analyse
- Was ist die Hauptfunktion von hochreinen Graphitelektroden bei der Wechselstromlaugung? Effiziente Metallrückgewinnung
- Welche technischen Vorteile bieten Kohlenstoff-Graphit-Elektroden für elektroaktive Biofilme? Optimieren Sie Ihre Bioforschung
- Was sind die Eigenschaften und Anwendungen einer Graphitfolienelektrode? Maximierung der Reaktionsfläche für die Massenelektrolyse
- Warum wird ein hochreiner Graphitstab als Gegenelektrode für EIS ausgewählt? Sicherstellung der Datenintegrität und chemischen Stabilität



















