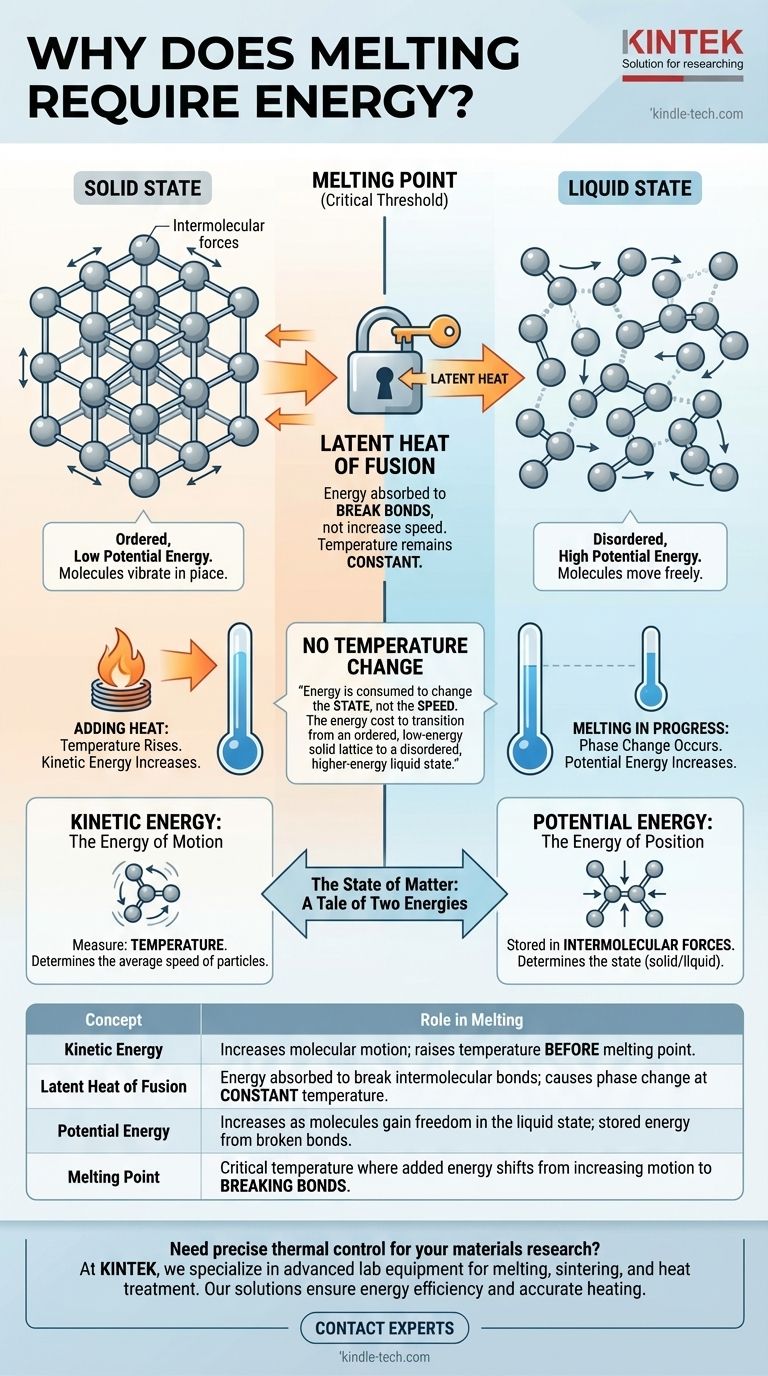
Auf molekularer Ebene erfordert Schmelzen Energie, weil diese Energie dazu verwendet wird, die starren Bindungen aufzubrechen, die Partikel in einer festen Struktur zusammenhalten. Diese Energie, bekannt als latente Wärme, erhöht nicht die Geschwindigkeit der Moleküle – und somit auch nicht die Temperatur –, sondern erhöht stattdessen deren potenzielle Energie, wodurch sie die Freiheit erhalten, sich als Flüssigkeit zu bewegen und aneinander vorbeizugleiten.
Der Hauptgrund, warum Schmelzen Energie ohne Temperaturänderung erfordert, ist, dass die Energie verbraucht wird, um den Zustand und nicht die Geschwindigkeit der Moleküle zu ändern. Es ist der Energieaufwand für den Übergang von einem geordneten, energiearmen festen Gitter zu einem ungeordneten, energiereicheren flüssigen Zustand.

Der Aggregatzustand: Eine Geschichte zweier Energien
Um die Energie des Schmelzens zu verstehen, müssen wir zunächst zwischen den zwei Arten von Energie unterscheiden, die Moleküle besitzen: kinetische und potenzielle.
Kinetische Energie: Die Energie der Bewegung
Kinetische Energie ist die Energie der Bewegung. In einer Substanz äußert sich dies als Vibration, Rotation und Translation ihrer Bestandteile, Atome oder Moleküle.
Die Temperatur einer Substanz ist ein direktes Maß für die durchschnittliche kinetische Energie ihrer Partikel. Wenn Sie Wärme hinzufügen und die Substanz heißer wird, liegt das daran, dass sich ihre Moleküle schneller bewegen.
Potenzielle Energie: Die Energie der Position
Potenzielle Energie ist in diesem Zusammenhang die Energie, die in den Kräften zwischen Molekülen, den sogenannten intermolekularen Kräften, gespeichert ist. Sie wird durch die Anordnung und den Abstand dieser Partikel bestimmt.
Eine fest gebundene, geordnete Struktur wie ein Feststoff hat eine geringe potenzielle Energie. Eine ungeordnete, frei fließende Struktur wie eine Flüssigkeit hat eine höhere potenzielle Energie, da die Moleküle weiter voneinander entfernt und weniger eingeschränkt sind.
Der feste Zustand: Eine hochgeordnete Struktur
In einem Feststoff sind die Partikel in einem festen, sich wiederholenden Muster, einem sogenannten Kristallgitter, eingeschlossen. Sie werden durch starke intermolekulare Kräfte an Ort und Stelle gehalten.
Obwohl sie nicht bewegungslos sind, ist ihre kinetische Energie auf das Vibrieren an Ort und Stelle beschränkt. Ihnen fehlt die Energie, um die Kräfte zu überwinden, die sie in dieser starren Struktur halten.
Den Schmelzprozess entschlüsseln
Der Phasenübergang vom Feststoff zur Flüssigkeit erfolgt in einem bestimmten, schrittweisen Prozess, bei dem Energie für eine sehr spezifische Aufgabe zugewiesen wird.
Wärmezufuhr: Die erste Phase
Wenn Sie beginnen, einem Feststoff (wie Eis unter seinem Gefrierpunkt) Wärme zuzuführen, wird die Energie als kinetische Energie absorbiert. Die Partikel vibrieren immer intensiver innerhalb des Gitters.
In dieser Phase steigt die Temperatur des Feststoffs stetig an.
Erreichen des Schmelzpunktes: Eine kritische Schwelle
Der Schmelzpunkt ist die Temperatur, bei der die Partikel so heftig vibrieren, dass sie kurz davor stehen, sich aus dem Gitter zu lösen.
Bei genau dieser Temperatur findet eine grundlegende Verschiebung statt. Jede zusätzlich zugeführte Energie erhöht nicht mehr die Vibrationsgeschwindigkeit (kinetische Energie). Stattdessen wird sie vollständig darauf gerichtet, die intermolekularen Kräfte zu überwinden.
Die Rolle der latenten Schmelzwärme
Die Energie, die erforderlich ist, um eine Substanz an ihrem Schmelzpunkt von einem Feststoff in eine Flüssigkeit umzuwandeln, wird als latente Schmelzwärme bezeichnet. Das Wort „latent“ bedeutet verborgen, weil diese Energiezufuhr keine Temperaturänderung bewirkt.
Stellen Sie es sich vor wie einen Schlüssel, um einen Käfig zu öffnen. Die Energie lässt den Bewohner nicht schneller im Käfig laufen; sie wird ausschließlich dazu verwendet, das Schloss zu öffnen und ihm das Herauskommen zu ermöglichen.
Von der Ordnung zur Unordnung: Der flüssige Zustand
Wenn Moleküle genügend latente Wärme absorbieren, lösen sie sich von ihren festen Positionen im Gitter. Die starre Struktur bricht zusammen, und die Substanz wird zu einer Flüssigkeit.
In diesem neuen flüssigen Zustand haben die Partikel eine viel höhere potenzielle Energie, aber ihre durchschnittliche kinetische Energie (Temperatur) ist dieselbe wie die des Feststoffs, aus dem sie gerade geschmolzen sind. Erst nachdem der gesamte Feststoff geschmolzen ist, führt eine weitere Wärmezufuhr zu einer Erhöhung der kinetischen Energie und somit der Temperatur der Flüssigkeit.
Den entscheidenden Unterschied verstehen: Wärme vs. Temperatur
Das Konzept der latenten Wärme löst einen häufigen Verwirrungspunkt. Es verdeutlicht den Unterschied zwischen Energiezufuhr und einer beobachtbaren Temperaturerhöhung.
Das häufige Missverständnis
Viele Menschen fragen sich: „Wenn ich schmelzendem Eis immer noch Wärme zuführe, warum bleibt die Temperatur bei 0 °C (32 °F)?“
Die Antwort ist, dass die Energie während eines Phasenübergangs eine andere Aufgabe hat. Ihre Priorität ist es, Bindungen zu brechen, nicht die Geschwindigkeit zu erhöhen.
Wärme ist Energieübertragung, Temperatur ist eine Messung
Wärme ist die Übertragung von thermischer Energie. Temperatur ist ein Maß für die durchschnittliche kinetische Energie.
Während des Schmelzens führen Sie dem System kontinuierlich Wärme zu, aber diese Energie wird in potenzielle Energie umgewandelt, wodurch die durchschnittliche kinetische Energie – und somit die Temperatur – unverändert bleibt.
Wie man dieses Prinzip anwendet
Das Verständnis dieses Konzepts ist grundlegend für viele reale Anwendungen und wissenschaftliche Bereiche.
- Wenn Ihr Hauptaugenmerk auf alltäglichen Beobachtungen liegt (wie einem Eiswürfel in einem Getränk): Die vom wärmeren Flüssigkeit absorbierte Energie wird als latente Wärme verwendet, um die molekularen Bindungen des Eises zu brechen, weshalb das Getränk kälter wird, während das Eis selbst bei konstanter Temperatur schmilzt.
- Wenn Ihr Hauptaugenmerk auf Ingenieurwesen oder Materialwissenschaft liegt: Die spezifische latente Schmelzwärme ist eine kritische Eigenschaft, die den Energieaufwand zum Schmelzen von Metallen oder anderen Materialien bestimmt und sich direkt auf Ofendesign, Energieverbrauch und Prozesseffizienz auswirkt.
- Wenn Ihr Hauptaugenmerk auf Chemie oder Physik liegt: Denken Sie daran, dass Phasenübergänge eine Verschiebung der potenziellen Energie (aufgrund von Änderungen der intermolekularen Kräfte) darstellen, während Temperaturänderungen eine Verschiebung der kinetischen Energie (aufgrund von Änderungen der Molekülbewegung) darstellen.
Das Erfassen der Rolle der latenten Wärme ist der Schlüssel zum Verständnis, wie Energie Veränderungen im physikalischen Zustand aller Materie antreibt.
Zusammenfassungstabelle:
| Konzept | Rolle beim Schmelzen |
|---|---|
| Kinetische Energie | Erhöht die Molekülbewegung; erhöht die Temperatur vor dem Schmelzpunkt. |
| Latente Schmelzwärme | Absorbierte Energie zum Brechen intermolekularer Bindungen; verursacht Phasenübergang bei konstanter Temperatur. |
| Potenzielle Energie | Erhöht sich, wenn Moleküle im flüssigen Zustand Freiheit gewinnen; gespeicherte Energie aus gebrochenen Bindungen. |
| Schmelzpunkt | Kritische Temperatur, bei der die zugeführte Energie von der Erhöhung der Bewegung zum Brechen von Bindungen übergeht. |
Benötigen Sie präzise thermische Kontrolle für Ihre Materialforschung? Bei KINTEK sind wir auf fortschrittliche Laborgeräte spezialisiert, die genaue Heiz- und Temperaturmanagement für Prozesse wie Schmelzen, Sintern und Wärmebehandlung liefern. Ob Sie mit Metallen, Keramiken oder anderen Materialien arbeiten, unsere Lösungen gewährleisten Energieeffizienz und reproduzierbare Ergebnisse. Kontaktieren Sie noch heute unsere Experten, um den perfekten Ofen oder das perfekte Heizsystem für die Anforderungen Ihres Labors zu finden.
Visuelle Anleitung
Ähnliche Produkte
- Labor-Muffelofen-Bodenhub-Muffelofen
- 1800℃ Muffelofen für Labor
- 1400℃ Muffelofen für Labor
- 1700℃ Muffelofen für Labor
- 1400℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
Andere fragen auch
- Was ist die Schmelztemperatur von Keramiken? Verständnis der Hochtemperatur-Materialleistung
- Was ist eine Muffelofen in der Lebensmittelanalytik? Ein Leitfaden zur präzisen Messung des Mineralstoffgehalts
- Wie wird der Aschegehalt mithilfe eines Muffelofens bestimmt? Erzielen Sie eine genaue Mineralanalyse
- Was verursacht einen Anstieg des Aschegehalts? Entdecken Sie die versteckten Übeltäter, die Ihre Ausrüstung schädigen.
- Was sind die verschiedenen Arten der Ascheanalyse? Erklärung der Methoden des Trocken- und Nassveraschung



















