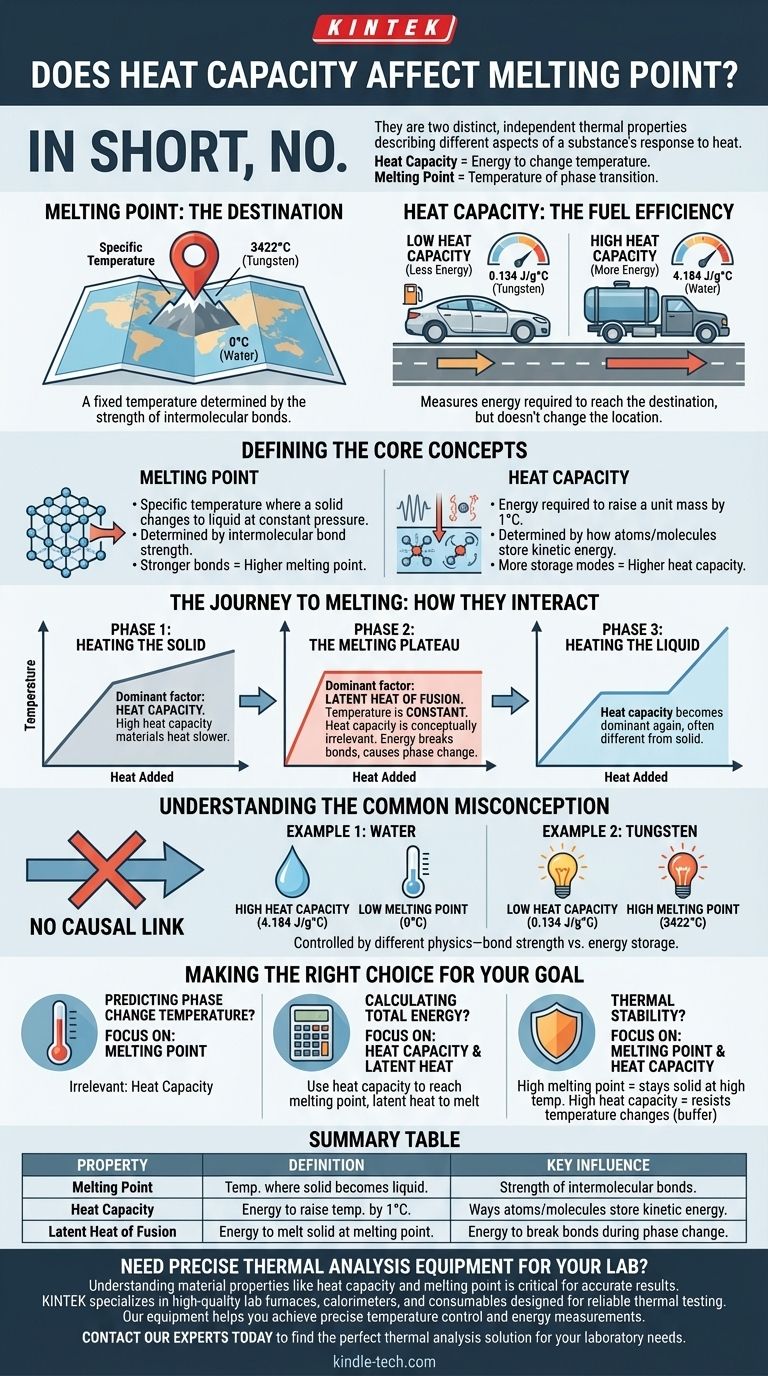
Kurz gesagt: Nein. Die Wärmekapazität beeinflusst oder bestimmt den Schmelzpunkt eines Materials nicht direkt. Es handelt sich um zwei unterschiedliche, unabhängige thermische Eigenschaften, die verschiedene Aspekte der Reaktion einer Substanz auf Wärme beschreiben. Die Wärmekapazität misst die Energie, die erforderlich ist, um die Temperatur eines Materials zu ändern, während der Schmelzpunkt die spezifische Temperatur ist, bei der es von einem festen in einen flüssigen Zustand übergeht.
Stellen Sie sich den Schmelzpunkt eines Materials als ein festes Ziel auf einer Karte vor (eine bestimmte Temperatur). Die Wärmekapazität hingegen ist wie die Kraftstoffeffizienz des Autos, mit dem Sie dorthin fahren. Ein Auto mit schlechter Kraftstoffeffizienz (hoher Wärmekapazität) benötigt mehr Kraftstoff (Energie), um das Ziel zu erreichen, aber der Standort des Ziels selbst ändert sich nicht.

Definition der Kernkonzepte
Um zu verstehen, warum diese Eigenschaften getrennt sind, müssen wir sie zunächst klar definieren. Sie beschreiben unterschiedliche physikalische Phänomene auf molekularer Ebene.
Was ist der Schmelzpunkt?
Der Schmelzpunkt ist die spezifische Temperatur, bei der ein reiner kristalliner Feststoff bei konstantem Druck in eine Flüssigkeit übergeht.
Diese Temperatur wird durch die Stärke der intermolekularen Bindungen bestimmt, die die Atome oder Moleküle in einem festen Kristallgitter zusammenhalten.
Um eine Substanz zu schmelzen, muss genügend Energie zugeführt werden, um diese Kräfte zu überwinden. Daher benötigen Materialien mit stärkeren Bindungen mehr Energie und haben einen höheren Schmelzpunkt.
Was ist Wärmekapazität?
Die spezifische Wärmekapazität ist die Menge an Wärmeenergie, die erforderlich ist, um die Temperatur einer Einheitsmasse einer Substanz um ein Grad (z. B. ein Kelvin oder ein Celsius) zu erhöhen.
Diese Eigenschaft wird dadurch bestimmt, auf wie viele Arten die Atome und Moleküle eines Materials kinetische Energie speichern können. Dazu gehören Schwingungen, Rotationen und Translationen.
Eine Substanz mit hoher Wärmekapazität kann eine große Menge Wärmeenergie mit nur einem geringen Temperaturanstieg aufnehmen.
Der Weg zum Schmelzen: Wie sie interagieren
Obwohl sie unabhängige Eigenschaften sind, spielen Wärmekapazität und Schmelzpunkt beide sequentielle Rollen im Prozess des Schmelzens einer Substanz. Der Prozess läuft in verschiedenen Phasen ab.
Phase 1: Erhitzen des Feststoffs
Dies ist die Phase, in der die Wärmekapazität der dominierende Faktor ist. Wenn Sie einem Feststoff Wärmeenergie zuführen, steigt seine Temperatur.
Ein Material mit hoher Wärmekapazität erwärmt sich langsamer als eines mit niedriger Wärmekapazität, vorausgesetzt, die Energiezufuhrrate ist gleich. Es "saugt" für jedes Grad Temperaturanstieg mehr Energie auf.
Phase 2: Das Schmelzplateau
Sobald das Material seinen Schmelzpunkt erreicht, geschieht etwas Entscheidendes: Seine Temperatur steigt nicht mehr an, selbst wenn Sie weiterhin Wärme zuführen.
Die gesamte zugeführte Energie wird nun ausschließlich dazu verwendet, die Bindungen der festen Struktur zu brechen, ein Prozess, der durch eine andere Eigenschaft, die latente Schmelzwärme, bestimmt wird.
Während dieses Phasenübergangs ist die Wärmekapazität konzeptionell irrelevant, da die Temperatur statisch ist. Die Energie bewirkt eine Zustandsänderung, keine Temperaturänderung.
Phase 3: Erhitzen der Flüssigkeit
Nachdem der gesamte Feststoff in eine Flüssigkeit umgewandelt wurde, beginnt die Temperatur der Substanz bei weiterer Wärmezufuhr wieder zu steigen.
Die flüssige Phase der Substanz hat ihre eigene spezifische Wärmekapazität, die oft von der Wärmekapazität ihrer festen Form abweicht.
Das häufige Missverständnis verstehen
Die Verwechslung dieser beiden Eigenschaften entsteht oft, weil beide für das thermische Verhalten eines Materials grundlegend sind. Die Verwechslung ihrer Korrelation mit Kausalität ist jedoch ein kritischer Fehler.
Die Falle von Korrelation vs. Kausalität
Es gibt keinen zuverlässigen kausalen Zusammenhang zwischen Wärmekapazität und Schmelzpunkt. Eine hohe Wärmekapazität impliziert keinen hohen Schmelzpunkt und umgekehrt.
Betrachten Sie diese Beispiele:
- Wasser hat eine sehr hohe spezifische Wärmekapazität (4,184 J/g°C), aber einen niedrigen Schmelzpunkt von 0°C.
- Wolfram hat eine viel niedrigere spezifische Wärmekapazität (0,134 J/g°C), aber einen der höchsten Schmelzpunkte aller Elemente, nämlich 3.422°C.
Dies zeigt, dass eine Eigenschaft nicht zur Vorhersage der anderen verwendet werden kann. Sie werden durch unterschiedliche zugrunde liegende physikalische Prinzipien gesteuert – Bindungsstärke für den Schmelzpunkt und Arten der Energiespeicherung für die Wärmekapazität.
Die richtige Wahl für Ihr Ziel treffen
Bei der Analyse der thermischen Eigenschaften eines Materials konzentrieren Sie sich auf die Eigenschaft, die Ihre Frage direkt beantwortet.
- Wenn Ihr Hauptaugenmerk auf der Vorhersage der Temperatur eines Phasenübergangs liegt: Betrachten Sie nur den Schmelzpunkt. Die Wärmekapazität ist irrelevant dafür, bei welcher Temperatur es schmilzt.
- Wenn Ihr Hauptaugenmerk auf der Berechnung des gesamten Energiebedarfs liegt: Sie müssen die Wärmekapazität verwenden, um die Energie zu ermitteln, die zum Erreichen des Schmelzpunkts benötigt wird, und dann die latente Schmelzwärme, um die Energie zu ermitteln, die zum vollständigen Schmelzen benötigt wird.
- Wenn Ihr Hauptaugenmerk auf der thermischen Stabilität liegt: Ein hoher Schmelzpunkt bedeutet, dass ein Material bei hohen Temperaturen fest bleibt. Eine hohe Wärmekapazität bedeutet, dass das Material Temperaturänderungen widersteht, was es zu einem guten thermischen Puffer macht.
Das Verständnis der unterschiedlichen Rollen von Wärmekapazität und Schmelzpunkt ist der Schlüssel zur genauen Vorhersage und Entwicklung des Verhaltens von Materialien unter thermischer Belastung.
Zusammenfassungstabelle:
| Eigenschaft | Definition | Wichtiger Einfluss |
|---|---|---|
| Schmelzpunkt | Die spezifische Temperatur, bei der ein Feststoff zu einer Flüssigkeit wird. | Stärke der intermolekularen Bindungen. |
| Wärmekapazität | Die Energie, die benötigt wird, um die Temperatur eines Materials um 1°C zu erhöhen. | Arten, wie Atome/Moleküle kinetische Energie speichern. |
| Latente Schmelzwärme | Die Energie, die benötigt wird, um einen Feststoff an seinem Schmelzpunkt zu schmelzen. | Energie zum Brechen von Bindungen während des Phasenübergangs. |
Benötigen Sie präzise thermische Analysegeräte für Ihr Labor? Das Verständnis von Materialeigenschaften wie Wärmekapazität und Schmelzpunkt ist entscheidend für genaue Ergebnisse. KINTEK ist spezialisiert auf hochwertige Laboröfen, Kalorimeter und Verbrauchsmaterialien, die für zuverlässige thermische Tests entwickelt wurden. Unsere Geräte helfen Ihnen, präzise Temperaturkontrolle und Energiemessungen zu erreichen und stellen sicher, dass Ihre Forschung und Qualitätskontrolle auf soliden Daten basieren. Kontaktieren Sie noch heute unsere Experten, um die perfekte thermische Analyselösung für Ihre Laboranforderungen zu finden.
Visuelle Anleitung
Ähnliche Produkte
- Labor-Muffelofen-Bodenhub-Muffelofen
- 1800℃ Muffelofen für Labor
- 1400℃ Muffelofen für Labor
- 1700℃ Muffelofen für Labor
- 1400℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
Andere fragen auch
- Wie werden CVD-Diamanten erkannt? Die Wissenschaft hinter der Identifizierung im Labor gezüchteter Diamanten
- Welche Eigenschaft besitzt KBr, die es für den Infrarotbereich geeignet macht? Entsperren Sie die Analyse der klaren IR-Spektroskopie
- Warum müssen Proben der Legierung Ni–20Cr–5Al in einem Laborofen getrocknet werden? Gewährleistung einer Präzision von 0,0001 g bei Korrosionsexperimenten
- Welche Schritte umfasst der Pulvermetallurgieprozess? Ein Leitfaden zur effizienten, endkonturnahen Fertigung
- Was sind die verschiedenen Sinterverfahren? Ein Leitfaden zu Festphasen- und Flüssigphasen- & Drucktechniken
- Wie lange dauert die Pyrolyse? Von Sekunden bis zu Tagen für Bioöl oder Biokohle
- Was ist die Funktion von KBr? Ein Schlüsselwerkzeug für die qualitativ hochwertige FTIR-Analyse von Feststoffen
- Warum ist destilliertes Wasser bei der Wahl der Wasserart für ein Laborwasserbad die beste Wahl?



















