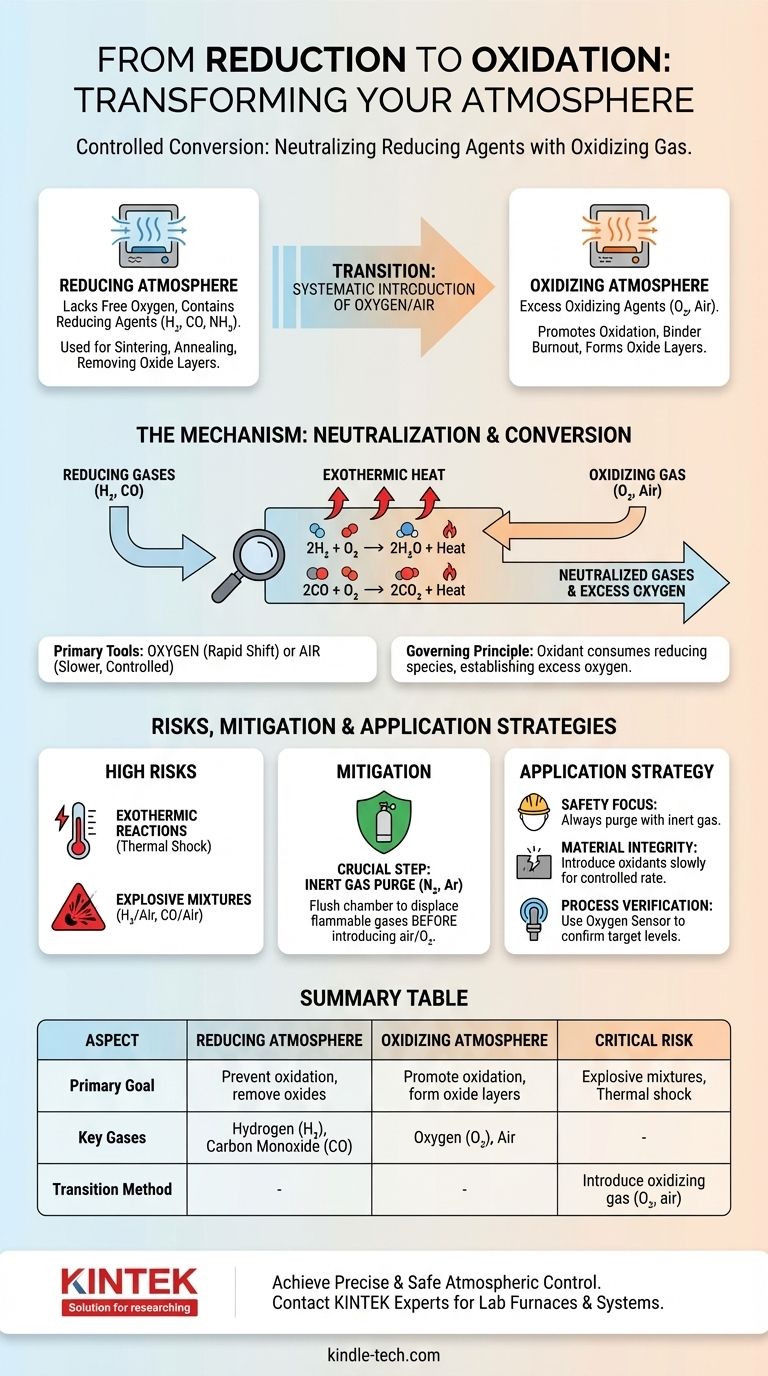
Die Umwandlung einer reduzierenden Atmosphäre in eine oxidierende wird durch die systematische Einführung eines oxidierenden Gases, meist Sauerstoff oder Luft, erreicht. Dieser Prozess neutralisiert die vorhandenen aktiven Reduktionsmittel wie Wasserstoff oder Kohlenmonoxid, indem er mit ihnen reagiert und stabilere Moleküle wie Wasser und Kohlendioxid bildet, wodurch sich das chemische Potenzial der Umgebung grundlegend verschiebt.
Die Umstellung von einer reduzierenden zu einer oxidierenden Atmosphäre ist eine kontrollierte chemische Umwandlung. Es geht nicht nur um Verdünnung, sondern darum, gezielt ein Oxidationsmittel zuzuführen, um die reduzierenden Spezies zu verbrauchen und einen Sauerstoffüberschuss zu erzeugen.
Verständnis der Kernkonzepte: Reduzierend vs. Oxidierend
Was definiert eine reduzierende Atmosphäre?
Eine reduzierende Atmosphäre ist eine Umgebung, der freier Sauerstoff fehlt und die aktive Reduktionsmittel enthält. Diese Mittel, wie Wasserstoff (H₂), Kohlenmonoxid (CO) oder dissoziierter Ammoniak (NH₃), geben leicht Elektronen ab oder entziehen Materialien, mit denen sie in Kontakt kommen, Sauerstoffatome.
Solche Atmosphären werden verwendet, um Oxidation zu verhindern oder Oxidschichten von Metallen und Keramiken während Hochtemperaturprozessen wie Sintern oder Glühen aktiv zu entfernen.
Was definiert eine oxidierende Atmosphäre?
Eine oxidierende Atmosphäre hingegen weist einen Überschuss an einem Oxidationsmittel auf, am häufigsten Sauerstoff (O₂). Diese Umgebung fördert die Oxidation, eine Reaktion, bei der ein Material Elektronen verliert oder sich mit Sauerstoff verbindet.
Luft, die zu etwa 21 % aus Sauerstoff besteht, ist die häufigste oxidierende Atmosphäre. Diese Umgebungen sind unerlässlich für Prozesse wie das Ausbrennen von Bindemitteln in Keramiken oder die Erzeugung spezifischer Oxidschichten auf der Oberfläche eines Materials.
Der Mechanismus des Übergangs: Von Reduktion zu Oxidation
Das Prinzip: Neutralisation durch Reaktion
Der Übergang beruht auf einem einfachen Prinzip: Ein Oxidationsmittel reagiert mit einem Reduktionsmittel und neutralisiert es. Um die Atmosphäre zu ändern, müssen Sie genügend Oxidationsmittel einführen, um alle vorhandenen reduzierenden Gase zu verbrauchen und dann einen Überschuss herzustellen.
Sauerstoff und Luft: Die primären Werkzeuge
Sauerstoff oder Luft sind die Standardgase, die für diese Umwandlung verwendet werden. Die Wahl zwischen ihnen hängt von der erforderlichen Reaktionsgeschwindigkeit und dem benötigten Kontrollniveau ab.
Reiner Sauerstoff bewirkt eine stärkere und schnellere Verschiebung, während Luft einen langsameren, verdünnteren und oft besser kontrollierbaren Übergang ermöglicht.
Die maßgeblichen chemischen Reaktionen
Wenn Sauerstoff in eine typische heiße reduzierende Atmosphäre eingeführt wird, reagiert er sofort mit den Reduktionsmitteln. Die primären Reaktionen sind bei Verarbeitungstemperaturen sehr günstig und spontan.
Für eine Wasserstoffatmosphäre:
2H₂ (Gas) + O₂ (Gas) → 2H₂O (Gas) + Wärme
Für eine Kohlenmonoxidatmosphäre:
2CO (Gas) + O₂ (Gas) → 2CO₂ (Gas) + Wärme
Die Atmosphäre wird erst dann wirklich oxidierend, wenn der gesamte H₂ oder CO in H₂O oder CO₂ umgewandelt und ein Überschuss an O₂ hergestellt wurde.
Verständnis der Risiken und Kompromisse
Hohes Risiko exothermer Reaktionen
Die Reaktionen, die Reduktionsmittel neutralisieren, sind stark exotherm, d.h. sie setzen eine erhebliche Wärmemenge frei. Eine schnelle Einführung von Sauerstoff kann einen plötzlichen Temperaturanstieg im Ofen verursachen, der die Ausrüstung oder das Produkt potenziell beschädigt.
Dieser Thermoschock kann empfindliche Materialien wie Keramiken reißen oder unerwünschte Phasenübergänge in Metallen verursachen.
Potenzial für explosive Gemische
Das kritischste Risiko ist die Entstehung einer explosiven Atmosphäre. Gemische aus Wasserstoff und Luft (zwischen 4 % und 75 % H₂) oder Kohlenmonoxid und Luft (zwischen 12 % und 75 % CO) sind explosiv.
Wenn eine Zündquelle vorhanden ist – wie ein heißes Element oder eine statische Entladung – kann eine schnelle, unkontrollierte Einführung von Luft oder Sauerstoff eine heftige Explosion verursachen. Sicherheitsprotokolle sind nicht verhandelbar.
Spülen mit einem Inertgas
Um diese Risiken zu mindern, wird oft ein entscheidender Zwischenschritt angewendet: das Spülen mit einem Inertgas. Bevor Luft eingeführt wird, wird die Ofenkammer mit einem Gas wie Stickstoff (N₂) oder Argon (Ar) gespült.
Dieses Spülen verdrängt das brennbare reduzierende Gas und verhindert die Bildung eines explosiven Gemisches, wenn schließlich Sauerstoff eingeführt wird.
Wie Sie dies in Ihrem Prozess anwenden
Ein kontrollierter Übergang ist für die Sicherheit und das Erreichen der gewünschten Materialeigenschaften von größter Bedeutung. Die richtige Strategie hängt ganz von Ihrem primären Ziel ab.
- Wenn Ihre primäre Priorität die Sicherheit ist: Spülen Sie das reduzierende Gas immer mit einem Inertgas wie Stickstoff, bevor Sie Luft oder Sauerstoff einführen.
- Wenn Ihre primäre Priorität die Materialintegrität ist: Führen Sie das oxidierende Gas langsam und kontrolliert ein, um einen Thermoschock durch die exotherme Reaktion zu vermeiden.
- Wenn Ihre primäre Priorität die Prozessverifizierung ist: Verwenden Sie einen Sauerstoffsensor oder Gasanalysator am Ofenabzug, um zu bestätigen, dass alle Reduktionsmittel verbraucht wurden und Sie den Ziel-Sauerstoffgehalt erreicht haben.
Die Beherrschung dieses atmosphärischen Übergangs ermöglicht Ihnen eine präzise Kontrolle über den endgültigen chemischen Zustand und die physikalischen Eigenschaften Ihres Materials.

Zusammenfassungstabelle:
| Aspekt | Reduzierende Atmosphäre | Oxidierende Atmosphäre |
|---|---|---|
| Primäres Ziel | Oxidation verhindern, Oxide entfernen | Oxidation fördern, Oxidschichten bilden |
| Schlüsselgase | Wasserstoff (H₂), Kohlenmonoxid (CO) | Sauerstoff (O₂), Luft |
| Übergangsmethode | Oxidierendes Gas (O₂, Luft) einführen, um Reduktionsmittel zu verbrauchen | Erreicht, nachdem Reduktionsmittel neutralisiert sind |
| Kritisches Risiko | Bildung explosiver Gemische während des Übergangs | Thermoschock durch exotherme Reaktionen |
Erzielen Sie eine präzise und sichere Atmosphärenkontrolle in Ihrem Labor.
Die Beherrschung des Übergangs von einer reduzierenden zu einer oxidierenden Atmosphäre ist entscheidend für die Materialintegrität und die Bedienersicherheit. Ob Sie Metalle sintern, Keramiken glühen oder neue Materialien entwickeln, die richtige Ausrüstung und Expertise sind unerlässlich.
KINTEK ist spezialisiert auf Laboröfen und Atmosphärenkontrollsysteme, die für präzisen, zuverlässigen und sicheren Betrieb konzipiert sind. Unsere Lösungen helfen Ihnen dabei:
- Explosive Gemische zu verhindern mit integrierten Sicherheitsfunktionen.
- Thermische Profile zu kontrollieren, um Schäden an Ihren Proben zu vermeiden.
- Prozessergebnisse zu überprüfen mit kompatibler Überwachungsausrüstung.
Lassen Sie KINTEK Ihr Partner für Labor-Exzellenz sein. Kontaktieren Sie noch heute unsere Experten, um Ihre spezifischen Anforderungen an Ofen- und Atmosphärenkontrollsysteme zu besprechen. Wir liefern die Ausrüstung und Verbrauchsmaterialien, um sicherzustellen, dass Ihre Prozesse sowohl erfolgreich als auch sicher sind.
Visuelle Anleitung
Ähnliche Produkte
- 1700℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- 1700℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
- 1400℃ Kammerofen mit kontrollierter Atmosphäre und Stickstoff- und Inertgasatmosphäre
- Hochtemperatur-Muffelofen für Laborentbinderung und Vorsintern
- Vertikaler Labortiegelofen
Andere fragen auch
- Warum werden Öfen mit kontrollierter Atmosphäre für die Modifizierung von NCD-Beschichtungen benötigt? Verbessern Sie die Biokompatibilität.
- Warum ist ein Atmosphärenrohrrohrofen für die Herstellung von kohlenstoffbeschichteten Silizium (C@Si) Anodenmaterialien notwendig?
- Welche Gefahren bergen Inertgase? Die stille, unentdeckbare Bedrohung durch Sauerstoffverdrängung
- Warum werden atmosphereskontrollierte Öfen für Verunreinigungen in Festkörperelektrolyten verwendet? Optimieren Sie jetzt Ihre Batterieforschung
- Was ist die Funktion eines Hochtemperatur-Atmosphäresofens bei der Biomasseverkokung? Optimieren Sie Ihre Kohlenstoffforschung
- Welche Rolle spielt hochreines Argon-Gas bei Gallium-dotierten Nanoferriten? Gewährleistung perfekter stöchiometrischer Präzision
- Was ist das Sintern bei Atmosphärendruck? Ein kostengünstiger Weg zu komplexen, dichten Bauteilen
- Was ist die Funktion von Inertgas? Verhinderung unerwünschter chemischer Reaktionen für einen kontrollierten Prozess



















