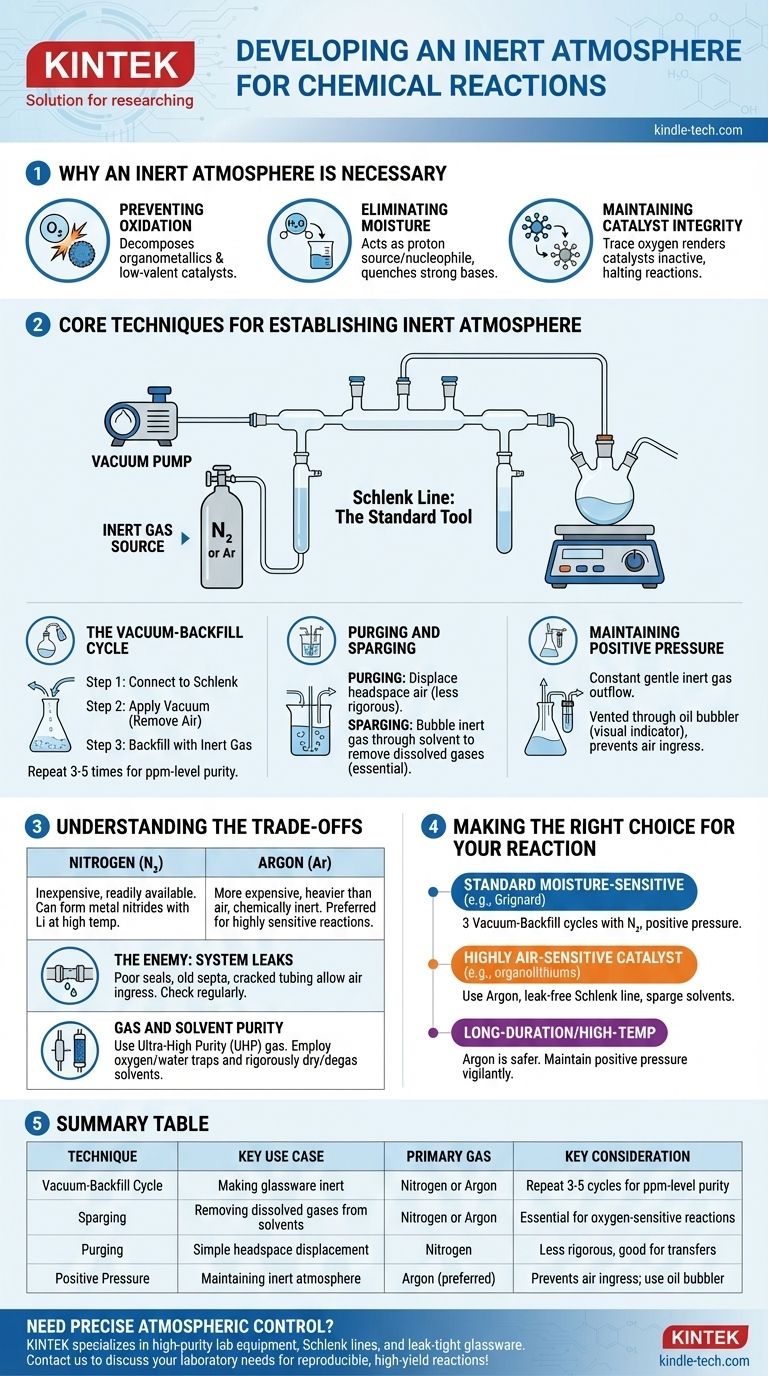
In der Praxis wird eine inerte Atmosphäre erzeugt, indem die reaktive Luft physikalisch aus einem Reaktionsgefäß entfernt und durch ein nicht-reaktives Gas, meist Stickstoff oder Argon, ersetzt wird. Dies wird typischerweise mit einem Dual-Manifold-System, einer sogenannten Schlenk-Linie, erreicht, die es einem Chemiker ermöglicht, zwischen dem Anlegen eines Vakuums an das Gefäß und dem Rückfüllen mit dem Inertgas zu wechseln. Dieser Zyklus wird mehrmals wiederholt, um sicherzustellen, dass aller Sauerstoff und alle Feuchtigkeit entfernt werden.
Das Hauptziel ist nicht einfach, ein Inertgas hinzuzufügen, sondern die bereits vorhandene reaktive Atmosphäre rigoros zu verdrängen und zu entfernen. Die Beherrschung dieser Kontrolle über die Reaktionsumgebung ist grundlegend, um unerwünschte Nebenreaktionen zu verhindern und die Integrität empfindlicher Materialien zu gewährleisten.

Warum eine inerte Atmosphäre notwendig ist
Viele chemische Reaktionen beinhalten Reagenzien oder erzeugen Produkte, die empfindlich auf Bestandteile der Umgebungsluft reagieren. Eine mangelnde Kontrolle der Atmosphäre kann zu fehlgeschlagenen Reaktionen, geringen Ausbeuten oder der Bildung gefährlicher Nebenprodukte führen.
Oxidation verhindern
Der häufigste Übeltäter ist molekularer Sauerstoff (O₂), ein starkes Oxidationsmittel. Er kann leicht mit vielen gängigen Reagenzien, insbesondere Organometallen, niedrigvalenten Metallkatalysatoren und radikalischen Zwischenprodukten, reagieren und diese zersetzen.
Feuchtigkeit eliminieren
Wasserdampf (H₂O) ist ein weiteres großes Problem. Er wirkt als Protonenquelle (eine schwache Säure) und als Nukleophil, was starke Basen (wie Grignard-Reagenzien oder Organolithiumverbindungen) abschrecken oder mit hoch elektrophilen Verbindungen (wie Säurechloriden) reagieren kann.
Katalysatorintegrität erhalten
In der Katalyse befindet sich der aktive Zustand eines Metallkatalysators oft in einem spezifischen, niedrigen Oxidationszustand. Der Kontakt mit selbst Spuren von Sauerstoff kann den Katalysator irreversibel oxidieren, ihn inaktiv machen und die Reaktion stoppen.
Kerntechniken zur Etablierung einer inerten Atmosphäre
Das Standardwerkzeug für diesen Prozess ist eine Schlenk-Linie, ein Glasverteiler, der sowohl mit einer Vakuumpumpe als auch mit einer Quelle für hochreines Inertgas verbunden ist. Diese Einrichtung ermöglicht zwei primäre Techniken.
Der Vakuum-Rückfüllzyklus
Dies ist die gängigste Methode, um Glasgeräte inert zu machen.
- Der leere, trockene Reaktionskolben wird an die Schlenk-Linie angeschlossen.
- Ein Vakuum wird angelegt, wodurch der Großteil der Luft aus dem Kolben entfernt wird.
- Das Vakuum wird geschlossen, und das Inertgasventil wird geöffnet, wodurch der Kolben mit Stickstoff oder Argon auf Umgebungsdruck rückgefüllt wird.
Dieser Zyklus wird typischerweise drei- bis fünfmal wiederholt, um die Konzentration von Sauerstoff und Feuchtigkeit auf vernachlässigbare Werte (Teile pro Million) zu reduzieren.
Spülen und Begasen (Sparging)
Spülen (Purging) beinhaltet einfach das Durchleiten eines konstanten Inertgasstroms durch den Kopfraum des Kolbens, um die Luft zu verdrängen. Dies ist eine weniger rigorose Methode, kann aber für einfache Transfers nützlich sein.
Begasen (Sparging) ist der Prozess, bei dem das Inertgas durch eine Flüssigkeit (wie ein Reaktionslösungsmittel) über eine lange Nadel oder ein Rohr geblasen wird. Dies ist unerlässlich, um gelöste Gase, insbesondere Sauerstoff, aus dem Lösungsmittel zu entfernen, bevor die Reaktion beginnt.
Aufrechterhaltung eines Überdrucks
Sobald die inerte Atmosphäre hergestellt ist, wird während des gesamten Experiments ein leichter Überdruck des Inertgases aufrechterhalten. Dies gewährleistet einen konstanten, sanften Gasausstrom, der verhindert, dass Luft in das System eindringt. Dieser Ausstrom wird typischerweise durch einen Öl- oder Quecksilberblubber abgeleitet, der auch als visueller Indikator für die Gasflussrate dient.
Die Kompromisse verstehen
Die Wahl des richtigen Gases und das Bewusstsein für Systembeschränkungen sind entscheidend für den Erfolg. Obwohl diese Techniken leistungsstark sind, sind sie nicht narrensicher.
Stickstoff vs. Argon
Stickstoff (N₂) ist das Arbeitspferd für die meisten Inertgas-Chemikalien. Er ist preiswert und leicht verfügbar. Unter bestimmten Bedingungen (z. B. Reaktionen mit Lithiummetall bei hohen Temperaturen) kann er jedoch reaktiv sein und Metallnitride bilden.
Argon (Ar) ist deutlich teurer, aber schwerer als Luft und unter praktisch allen Laborbedingungen chemisch inert. Es ist das Gas der Wahl für hochsensible Reaktionen oder solche, die Metalle betreffen, die mit N₂ reagieren können.
Der Feind: Systemlecks
Die Wirksamkeit Ihrer inerten Atmosphäre ist nur so gut wie die schwächste Dichtung in Ihrem Aufbau. Schlecht gefettete Glasverbindungen, alte Gummisepta oder rissige Schläuche können dazu führen, dass Luft langsam in das System zurückleckt und die Reaktion beeinträchtigt. Die regelmäßige Überprüfung auf Lecks mit einem Vakuummeter ist Standardpraxis.
Gas- und Lösungsmittelreinheit
Es reicht nicht aus, einfach einen Tank mit Inertgas zu verwenden. Für extrem empfindliche Arbeiten ist ultrahochreines (UHP) Gas erforderlich. Zusätzlich können Sauerstoff- oder Wasserfallen in Reihe geschaltet werden, um die letzten Spuren von Verunreinigungen aus dem Gas zu "schrubben", bevor es in den Verteiler gelangt. Ebenso müssen Lösungsmittel vor Gebrauch rigoros getrocknet und entgast (oft durch Begasen) werden.
Die richtige Wahl für Ihre Reaktion treffen
Ihr spezifischer Ansatz sollte auf die Empfindlichkeit Ihrer Reagenzien und das Ziel Ihres Experiments zugeschnitten sein.
- Wenn Ihr Hauptaugenmerk auf einer Standard-, feuchtigkeitsempfindlichen Reaktion (z. B. Grignard) liegt: Drei Vakuum-Rückfüllzyklen mit Stickstoff und die Aufrechterhaltung eines Überdrucks sind typischerweise ausreichend.
- Wenn Ihr Hauptaugenmerk auf einer Reaktion mit einem hoch luftempfindlichen Katalysator oder Reagenz (z. B. Organolithiumverbindungen, niedrigvalentes Nickel) liegt: Die Verwendung von Argon, die Sicherstellung einer leckfreien Schlenk-Linie und das Begasen Ihrer Lösungsmittel sind entscheidend für den Erfolg.
- Wenn Ihr Hauptaugenmerk auf einer langwierigen oder Hochtemperaturreaktion liegt: Argon ist die sicherere Wahl, um potenzielle Nebenreaktionen mit Stickstoff zu vermeiden, und Sie müssen während der gesamten Reaktionszeit wachsam sein, um den Überdruck aufrechtzuerhalten.
Die Beherrschung dieser atmosphärischen Kontrolltechniken gibt Ihnen die wahre Kontrolle über die chemische Umgebung und verwandelt eine Reaktion von einer Zufallsangelegenheit in einen vorhersehbaren, reproduzierbaren Prozess.
Zusammenfassungstabelle:
| Technik | Wichtiger Anwendungsfall | Primärgas | Wichtige Überlegung |
|---|---|---|---|
| Vakuum-Rückfüllzyklus | Inertisierung von Glasgeräten | Stickstoff oder Argon | 3-5 Zyklen für ppm-Reinheit wiederholen |
| Begasen (Sparging) | Entfernung gelöster Gase aus Lösungsmitteln | Stickstoff oder Argon | Unerlässlich für sauerstoffempfindliche Reaktionen |
| Spülen (Purging) | Einfache Kopfraumverdrängung | Stickstoff | Weniger rigoros, gut für Transfers |
| Überdruck | Aufrechterhaltung inerter Atmosphäre | Argon (bevorzugt) | Verhindert Lufteintritt; Ölblubber verwenden |
Benötigen Sie präzise atmosphärische Kontrolle für Ihre empfindlichen Reaktionen? KINTEK ist spezialisiert auf hochreine Laborausrüstung und Verbrauchsmaterialien, einschließlich Schlenk-Linien, Gasreinigungssystemen und leckdichten Glasgeräten. Unsere Experten helfen Ihnen gerne bei der Auswahl der richtigen Einrichtung, um Oxidation zu verhindern, Feuchtigkeit zu eliminieren und die Katalysatorintegrität zu erhalten. Kontaktieren Sie uns noch heute, um Ihre spezifischen Laboranforderungen zu besprechen und reproduzierbare, ertragreiche Reaktionen zu erzielen!
Visuelle Anleitung
Ähnliche Produkte
- 1200℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- 1700℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- 1400℃ Kammerofen mit kontrollierter Atmosphäre und Stickstoff- und Inertgasatmosphäre
- Kontrollierter Hochtemperatur-Wasserstoff-Ofen
- 1400℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
Andere fragen auch
- Warum wird Stickstoff in Glühöfen verwendet? Um Oxidation und Entkohlung für eine überlegene Metallqualität zu verhindern
- Was sorgt für eine inerte Atmosphäre? Erreichen Sie Sicherheit und Reinheit mit Stickstoff, Argon oder CO2
- Was ist ein inerter Zustand? Ein Leitfaden zur Vermeidung von Bränden und Explosionen
- Kann Stickstoff zum Löten verwendet werden? Wichtige Bedingungen und Anwendungen erklärt
- Was versteht man unter einer Inertatmosphäre? Ein Leitfaden zur Verhinderung von Oxidation und Gewährleistung der Sicherheit



















