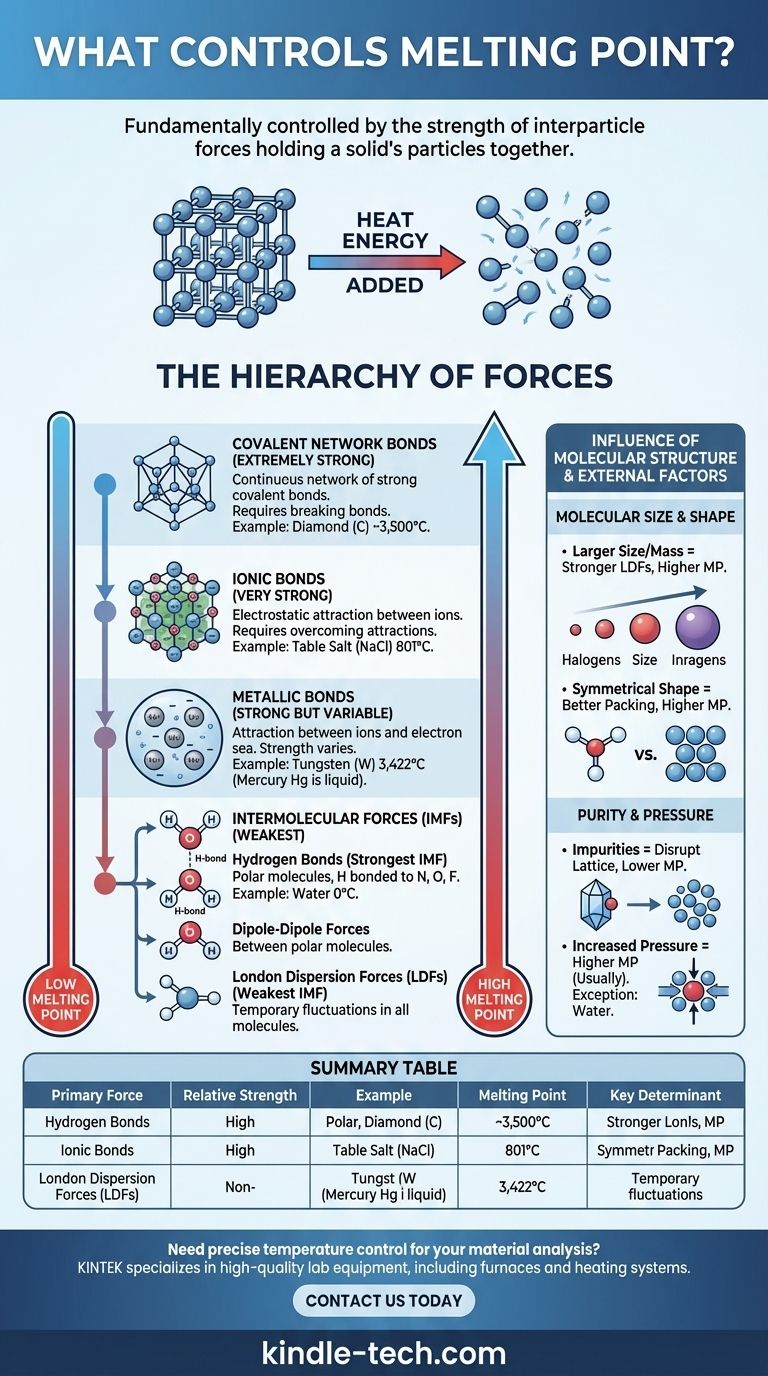
Der Schmelzpunkt einer Substanz wird fundamental durch die Stärke der Kräfte bestimmt, die ihre Teilchen zusammenhalten. In einem Festkörper sind die Teilchen (Atome, Ionen oder Moleküle) in einer festen, geordneten Anordnung, dem Kristallgitter, fixiert. Um den Feststoff zu schmelzen, muss genügend Wärmeenergie zugeführt werden, damit diese Teilchen diese Kräfte überwinden und als Flüssigkeit aneinander vorbeigleiten können. Stärkere Kräfte erfordern daher mehr Energie zum Brechen, was zu einem höheren Schmelzpunkt führt.
Das Kernprinzip ist einfach: Beim Schmelzen werden nicht die Teilchen selbst gebrochen, sondern die Anziehungskräfte zwischen ihnen müssen überwunden werden. Die Art und Stärke dieser interpartikulären Kräfte – von mächtigen Ionenbindungen bis hin zu schwachen intermolekularen Anziehungskräften – sind die Hauptbestimmungsfaktoren für den Schmelzpunkt einer Substanz.

Die Hierarchie der Kräfte
Die immense Variation der Schmelzpunkte – von -259°C für Wasserstoff bis zu 3.422°C für Wolfram – lässt sich durch die Klassifizierung der Kräfte verstehen, die einen Feststoff zusammenhalten. Diese Kräfte existieren in einer klaren Hierarchie der Stärke.
Ionenbindungen (Sehr stark)
In ionischen Verbindungen wie Kochsalz (NaCl) sind die Teilchen positiv und negativ geladene Ionen. Sie werden durch starke elektrostatische Anziehungskräfte in einem starren Kristallgitter zusammengehalten.
Die Überwindung dieser starken Ionenbindungen erfordert eine gewaltige Menge an thermischer Energie. Folglich weisen ionische Verbindungen durchweg sehr hohe Schmelzpunkte auf.
Kovalente Netzwerkbindungen (Extrem stark)
In kovalenten Netzwerkfeststoffen sind Atome durch ein riesiges, kontinuierliches Netzwerk starker kovalenter Bindungen verbunden. Es gibt keine einzelnen Moleküle; der gesamte Kristall ist im Wesentlichen ein einziges riesiges Molekül.
Substanzen wie Diamant (Kohlenstoff) und Quarz (Siliziumdioxid) sind Paradebeispiele. Um sie zu schmelzen, müssen diese extrem starken kovalenten Bindungen aufgebrochen werden, was enorme Energiemengen erfordert und zu außergewöhnlich hohen Schmelzpunkten führt.
Metallische Bindungen (Stark, aber variabel)
Metalle bestehen aus einem Gitter positiver Metallionen, die in einem „Meer“ delokalisierter Elektronen sitzen, die sich frei in der gesamten Struktur bewegen. Die Anziehung zwischen den positiven Ionen und diesem Elektronenmeer bildet die metallische Bindung.
Die Stärke dieser Bindung und damit der Schmelzpunkt variieren stark. Dies hängt von Faktoren wie der Ladung des Ions und der Anzahl der delokalisierten Elektronen ab. Deshalb ist Quecksilber bei Raumtemperatur eine Flüssigkeit, während Wolfram einen der höchsten Schmelzpunkte aller Elemente aufweist.
Intermolekulare Kräfte (Am schwächsten)
Bei Molekülverbindungen (wie Wasser, Zucker oder Wachs) sind die Kräfte, die beim Schmelzen überwunden werden müssen, die intermolekularen Kräfte (IMFs) – die Anziehungskräfte zwischen einzelnen Molekülen. Diese sind deutlich schwächer als die oben genannten ionischen, kovalenten oder metallischen Bindungen.
Es gibt drei Haupttypen von IMFs:
- Wasserstoffbrückenbindungen: Die stärkste Art von IMF. Sie tritt in polaren Molekülen auf, bei denen Wasserstoff direkt an ein stark elektronegatives Atom (Stickstoff, Sauerstoff oder Fluor) gebunden ist. Der relativ hohe Schmelzpunkt von Wasser (0°C) ist auf diese starken Wasserstoffbrückenbindungen zurückzuführen.
- Dipol-Dipol-Kräfte: Treten zwischen polaren Molekülen auf, die permanente positive und negative Enden haben. Diese Kräfte sind schwächer als Wasserstoffbrückenbindungen.
- London-Dispersionskräfte (LDFs): Die schwächste IMF, die in allen Molekülen vorhanden ist. Sie entstehen durch vorübergehende, zufällige Schwankungen in der Elektronenverteilung. Obwohl sie individuell schwach sind, kann ihre kumulative Wirkung bei größeren Molekülen erheblich sein.
Der Einfluss der Molekülstruktur
Über die Art der Kraft hinaus spielen die spezifische Größe und Form der Teilchen eine entscheidende Rolle, insbesondere bei Molekülverbindungen.
Molekülgröße und -masse
Bei Verbindungen mit der gleichen primären intermolekularen Kraft (z. B. LDFs) haben größere Moleküle höhere Schmelzpunkte. Dies liegt daran, dass größere Moleküle mehr Elektronen besitzen, was zu einer stärker „polarisierbaren“ Elektronenwolke führt, die stärkere London-Dispersionskräfte zur Folge hat.
Dieser Trend zeigt sich deutlich bei den Halogenen: Der Schmelzpunkt steigt, wenn man von Fluor (F₂) zu Iod (I₂) übergeht.
Molekülform und Packungseffizienz
Die Fähigkeit eines Moleküls, sich eng und effizient in einem Kristallgitter anzuordnen, hat einen großen Einfluss. Symmetrische Moleküle haben oft höhere Schmelzpunkte als weniger symmetrische Isomere, selbst wenn sie die gleiche Formel und Masse haben.
Symmetrische Formen ermöglichen es den Molekülen, sich im festen Zustand enger zusammenzulagern, wodurch die Wirksamkeit ihrer intermolekularen Kräfte maximiert wird. Das Aufbrechen dieser gut organisierten Struktur erfordert mehr Energie.
Verständnis der Kompromisse und Nuancen
Die Vorhersage von Schmelzpunkten erfordert die Abwägung dieser miteinander verbundenen Faktoren.
Reinheit verändert alles
Die obigen Prinzipien gelten für eine reine Substanz. Verunreinigungen stören das geordnete Kristallgitter und schwächen die Gesamtstruktur.
Diese Störung erleichtert das Schmelzen des Feststoffs. Folglich schmilzt eine unreine Substanz bei einer niedrigeren Temperatur und über einen breiteren Bereich als ihr reines Gegenstück. Dieses Phänomen wird als Schmelzpunkterniedrigung bezeichnet.
Der Druck spielt eine Rolle
Schmelzpunkte werden typischerweise bei Standardatmosphärendruck angegeben. Bei den meisten Substanzen erhöht eine Druckerhöhung den Schmelzpunkt, da sie die Teilchen physisch näher zusammendrückt und die Gitterstruktur verstärkt.
Wasser ist eine berühmte und wichtige Ausnahme. Da festes Eis weniger dicht ist als flüssiges Wasser, begünstigt erhöhter Druck die dichtere flüssige Phase und senkt dadurch den Schmelzpunkt.
Anwendung auf Ihre Analyse
Beim Vergleich von Substanzen sollten Sie einen systematischen Ansatz verwenden, um die wichtigsten beteiligten Faktoren zu identifizieren.
- Wenn Ihr Hauptaugenmerk auf dem Vergleich verschiedener Feststoffklassen liegt: Identifizieren Sie zuerst die primäre Bindungskraft – ionisch, kovalentes Netzwerk, metallisch oder intermolekular. Dies liefert den wichtigsten Indikator für den relativen Schmelzpunkt.
- Wenn Ihr Hauptaugenmerk auf dem Vergleich von zwei Molekülverbindungen liegt: Bestimmen Sie die stärkste intermolekulare Kraft, die jede von ihnen besitzt (Wasserstoffbrückenbindungen > Dipol-Dipol > LDFs). Die Verbindung mit der stärkeren IMF hat im Allgemeinen den höheren Schmelzpunkt.
- Wenn Ihr Hauptaugenmerk auf ähnlichen unpolaren Molekülen liegt: Das Molekül mit der größeren Masse und Oberfläche hat stärkere London-Dispersionskräfte und somit einen höheren Schmelzpunkt.
- Wenn Ihr Hauptaugenmerk auf Isomeren liegt (gleiche Formel, unterschiedliche Form): Das symmetrischere Molekül, das sich effizienter in ein Kristallgitter packen kann, hat oft den höheren Schmelzpunkt.
Durch das Verständnis dieser Hierarchie der Kräfte und des Einflusses der Struktur können Sie das Schmelzverhalten nahezu jeder Substanz systematisch erklären.
Zusammenfassungstabelle:
| Primäre Kraftart | Relative Stärke | Beispielsubstanz | Schmelzpunkt | Hauptbestimmungsfaktor |
|---|---|---|---|---|
| Kovalentes Netzwerk | Extrem stark | Diamant (C) | ~3.500°C | Brechen kovalenter Bindungen in einem kontinuierlichen Gitter |
| Ionenbindungen | Sehr stark | Natriumchlorid (NaCl) | 801°C | Überwindung elektrostatischer Anziehungskräfte zwischen Ionen |
| Metallische Bindungen | Stark (Variabel) | Wolfram (W) | 3.422°C | Stärke der Ionen-Elektronen-Meer-Anziehung |
| Intermolekulare Kräfte | Am schwächsten | Wasser (H₂O) | 0°C | Wasserstoffbrückenbindungen, Dipol-Dipol, London-Dispersionskräfte |
Benötigen Sie eine präzise Temperaturkontrolle für Ihre Materialanalyse? Das Verständnis von Schmelzpunkten ist entscheidend für zuverlässige Laborergebnisse. Bei KINTEK sind wir auf hochwertige Laborgeräte spezialisiert, einschließlich Öfen und Heizsystemen für die genaue thermische Analyse. Egal, ob Sie mit hochschmelzenden Metallen oder empfindlichen Molekülverbindungen arbeiten, unsere Lösungen gewährleisten eine konsistente Leistung. Kontaktieren Sie uns noch heute, um zu besprechen, wie unsere Produkte die Fähigkeiten Ihres Labors erweitern und Ihre Forschung unterstützen können. Kontaktieren Sie uns über unser Kontaktformular, um loszulegen!
Visuelle Anleitung
Ähnliche Produkte
- Labor-Muffelofen-Bodenhub-Muffelofen
- 1800℃ Muffelofen für Labor
- 1400℃ Muffelofen für Labor
- 1700℃ Muffelofen für Labor
- 1400℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
Andere fragen auch
- Was sind die Phasen des Metallschmelzens? Den 3-stufigen Prozess vom Feststoff zur Flüssigkeit meistern
- Verändert Gießen die Materialeigenschaften? Verstehen Sie den mikrostrukturellen Einfluss auf die Leistung
- Was sind die vier Schritte des Wärmebehandlungsprozesses? Meistern Sie die 3 Kernphasen für überragende Ergebnisse
- Bei welcher Temperatur schmilzt Keramik? Ein Leitfaden zur Hitzebeständigkeit von Keramik
- Welche Vorsichtsmaßnahmen sind bei einem Muffelofen zu beachten? Wesentliche Sicherheitsprotokolle für Ihr Labor



















