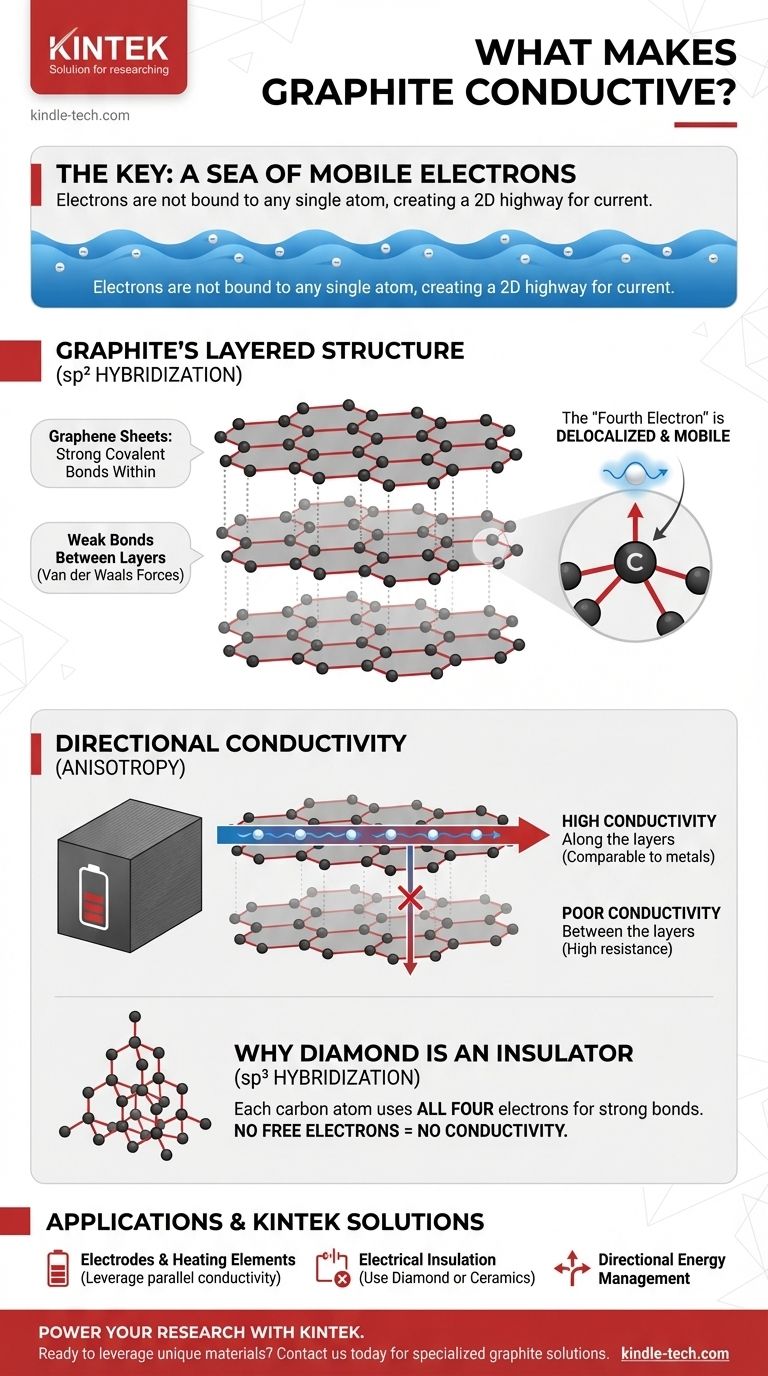
Im Kern wird die elektrische Leitfähigkeit in Graphit durch ein Meer mobiler Elektronen verursacht, die an kein einzelnes Atom gebunden sind. Dieses einzigartige Elektronenverhalten ist ein direktes Ergebnis der spezifischen geschichteten Atomstruktur von Graphit und der Art und Weise, wie seine Kohlenstoffatome miteinander verbunden sind.
Die entscheidende Erkenntnis ist, dass Graphit, während die meisten Nichtmetalle ihre Elektronen fixieren, durch seine einzigartige schichtartige Struktur ein Elektron pro Atom freigibt, das sich bewegen kann. Dieses „delokalisierte“ Elektron erzeugt eine zweidimensionale Elektronenautobahn, die es Graphit ermöglicht, Elektrizität ähnlich wie ein Metall zu leiten.

Die Grundlage: Die Schichtstruktur von Graphit
Um den Elektronenfluss zu verstehen, müssen wir zunächst die physische Form des Materials visualisieren. Graphit ist keine zufällige Ansammlung von Atomen; es ist ein hochorganisierter Kristall.
Ein Stapel von Graphenschichten
Graphit besteht aus unzähligen Schichten von Kohlenstoffatomen. Jede einzelne Schicht, bekannt als Graphenschicht, ist eine flache, zweidimensionale Ebene.
Starke Bindungen innen, schwache Bindungen dazwischen
Innerhalb jeder Schicht sind die Kohlenstoffatome in einem hexagonalen Wabenmuster angeordnet, verbunden durch extrem starke kovalente Bindungen. Die Bindungen, die die einzelnen Schichten zusammenhalten, sind jedoch sehr schwach (Van-der-Waals-Kräfte).
Die Rolle des Elektrons: Die Leitfähigkeit freisetzen
Die spezifische Art der Bindungen innerhalb der Graphenschichten ist die wahre Quelle der Leitfähigkeit von Graphit.
Die sp²-Hybridisierungsbindung
Jedes Kohlenstoffatom verfügt über vier Außenschalenelektronen, die für die Bindung zur Verfügung stehen. In Graphit verwendet jedes Atom drei dieser Elektronen, um starke, flache Bindungen mit seinen drei Nachbarn in der hexagonalen Schicht zu bilden.
Das „vierte Elektron“ erzeugt ein Meer an Mobilität
Dies hinterlässt ein Elektron pro Kohlenstoffatom, das nicht am primären Bindungsgerüst beteiligt ist. Dieses Elektron besetzt einen anderen Orbitaltyp (p-Orbital) und ist nicht mehr an sein ursprüngliches Atom gebunden.
Stattdessen verschmelzen diese „vierten Elektronen“ aller Atome in einer Schicht zu einem delokalisierten Elektronenmeer. Diese Elektronen können sich frei über die gesamte zweidimensionale Oberfläche ihrer Graphenschicht bewegen.
Wie mobile Elektronen Strom ermöglichen
Elektrischer Strom ist einfach der Fluss von Ladung. Wenn eine Spannung an ein Stück Graphit angelegt wird, wird dieser riesige Pool mobiler Elektronen leicht entlang der Graphenschichten verschoben, wodurch ein starker elektrischer Strom entsteht.
Die Kompromisse verstehen: Gerichtete Leitfähigkeit
Die Leitfähigkeit von Graphit ist nicht in alle Richtungen gleichmäßig. Diese Eigenschaft, bekannt als Anisotropie, ist bei jeder praktischen Anwendung ein entscheidender Faktor.
Hohe Leitfähigkeit entlang der Schichten
Elektrizität fließt außergewöhnlich gut parallel zu den Graphenschichten. Das delokalisierte Elektronenmeer bietet einen nahezu ungehinderten Weg für den Strom, wodurch die Leitfähigkeit von Graphit in dieser Richtung mit der vieler Metalle vergleichbar ist.
Geringe Leitfähigkeit zwischen den Schichten
Im Gegensatz dazu ist es für Elektronen sehr schwierig, von einer Schicht zur nächsten zu springen. Der große Abstand und die schwachen Kräfte zwischen den Schichten erzeugen einen hohen Widerstand, was Graphit zu einem schlechten Leiter senkrecht zu seinen Schichten macht.
Warum ist Diamant nicht leitfähig? Ein wichtiger Vergleich
Um die Einzigartigkeit von Graphit vollständig zu würdigen, ist ein Vergleich mit Diamant, einer anderen Form von reinem Kohlenstoff, hilfreich.
Die sp³-Bindung in Diamant
In Diamant verwendet jedes Kohlenstoffatom alle vier seiner Außenelektronen, um starke kovalente Bindungen mit vier benachbarten Atomen in einem starren, dreidimensionalen Gitter zu bilden.
Keine freien Elektronen, keine Leitfähigkeit
Da jedes Elektron in einer festen, lokalisierten Bindung eingeschlossen ist, stehen keine mobilen Elektronen zur Verfügung, um einen Strom zu transportieren. Deshalb ist Diamant einer der bekanntesten elektrischen Isolatoren.
Wie Sie dies auf Ihr Ziel anwenden
Die einzigartigen Eigenschaften der Leitfähigkeit von Graphit bestimmen seine Verwendung in verschiedenen Anwendungen.
- Wenn Ihr Hauptaugenmerk auf der Herstellung einer Elektrode oder eines Heizelements liegt: Nutzen Sie die ausgezeichnete Leitfähigkeit von Graphit entlang seiner Ebenen und richten Sie das Material so aus, dass der Strom parallel zu den Graphenschichten fließt.
- Wenn Ihr Hauptaugenmerk auf der elektrischen Isolierung liegt: Graphit ist die falsche Wahl; ein Material wie Diamant oder eine Keramik ist erforderlich, da diese keine freien Elektronen besitzen.
- Wenn Ihr Hauptaugenmerk auf der gerichteten Verwaltung von Wärme oder Elektrizität liegt: Die anisotrope Natur von Graphit ist ein Vorteil, da sie es Ihnen ermöglicht, Energie entlang einer Achse zu leiten, während entlang einer anderen Achse isoliert wird.
Letztendlich dient Graphit als perfektes Beispiel dafür, wie die Atomstruktur eines Materials seine grundlegendsten Eigenschaften direkt bestimmt.
Zusammenfassungstabelle:
| Wichtiger Faktor | Rolle bei der Leitfähigkeit |
|---|---|
| sp²-Hybridisierung | Erzeugt ein 2D-hexagonales Gitter und lässt ein Elektron pro Atom delokalisiert zurück. |
| Delokalisierte Elektronen | Bilden ein „Meer“ mobiler Ladungsträger, die sich frei innerhalb einer Graphenschicht bewegen können. |
| Schichtstruktur | Ermöglicht hohe Leitfähigkeit entlang der Schichten, aber geringe Leitfähigkeit zwischen ihnen (Anisotropie). |
| Vergleich mit Diamant (sp³) | Diamant hat keine freien Elektronen (alle Elektronen sind gebunden), was ihn zu einem Isolator macht. |
Sind Sie bereit, die einzigartigen leitfähigen Eigenschaften von Graphit in Ihrem Labor zu nutzen?
Bei KINTEK sind wir auf hochwertige Laborgeräte und Verbrauchsmaterialien spezialisiert. Ob Sie Graphit für Elektroden, Heizelemente oder spezielle Anwendungen benötigen, unsere Materialien sind darauf ausgelegt, überlegene Leistung und gerichtete Leitfähigkeit zu bieten.
Kontaktieren Sie uns noch heute, um zu besprechen, wie unsere Lösungen Ihre Forschung und Innovation vorantreiben können. Lassen Sie sich von unseren Experten bei der Auswahl der perfekten Materialien für Ihre spezifischen Laboranforderungen helfen.
Kontaktieren Sie jetzt unser Team →
Visuelle Anleitung
Ähnliche Produkte
- Vertikaler Hochtemperatur-Graphit-Vakuum-Graphitierungs-Ofen
- Graphit-Vakuum-Durchlaufgraphitierungsöfen
- Graphitierungs-Vakuumofen für ultrahohe Temperaturen
- Graphit-Vakuumofen Hochwärmeleitfähige Folien-Graphitierungsöfen
- 1400℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
Andere fragen auch
- Was sind die Eigenschaften von Graphitmaterial? Unübertroffene Leistung bei extremer Hitze
- Was ist ein Verkokungsofen? Verwandeln Sie Biomasseabfälle effizient in wertvolle Holzkohle
- Was ist der Zweck der Karbonisierung? Organische Materialien in wertvolle Kohlenstoffprodukte umwandeln
- Was misst ein Graphitofen? Ein Schlüsselwerkzeug für Spurenanalyse und Hochtemperaturverarbeitung
- Welche Vorteile bietet Graphit? Erschließen Sie überragende Leistung in Hochtemperaturprozessen
- Was ist der Unterschied zwischen Graphitrohr- und Flammen-AAS? Wählen Sie die richtige Technik für Ihr Labor
- Was ist Hochtemperatur-Graphitmaterial? Die ultimative Lösung für extreme Hitzeanwendungen
- Warum ist Graphit der beste Wärmeleiter? Sein richtungsabhängiger thermischer Vorteil



















