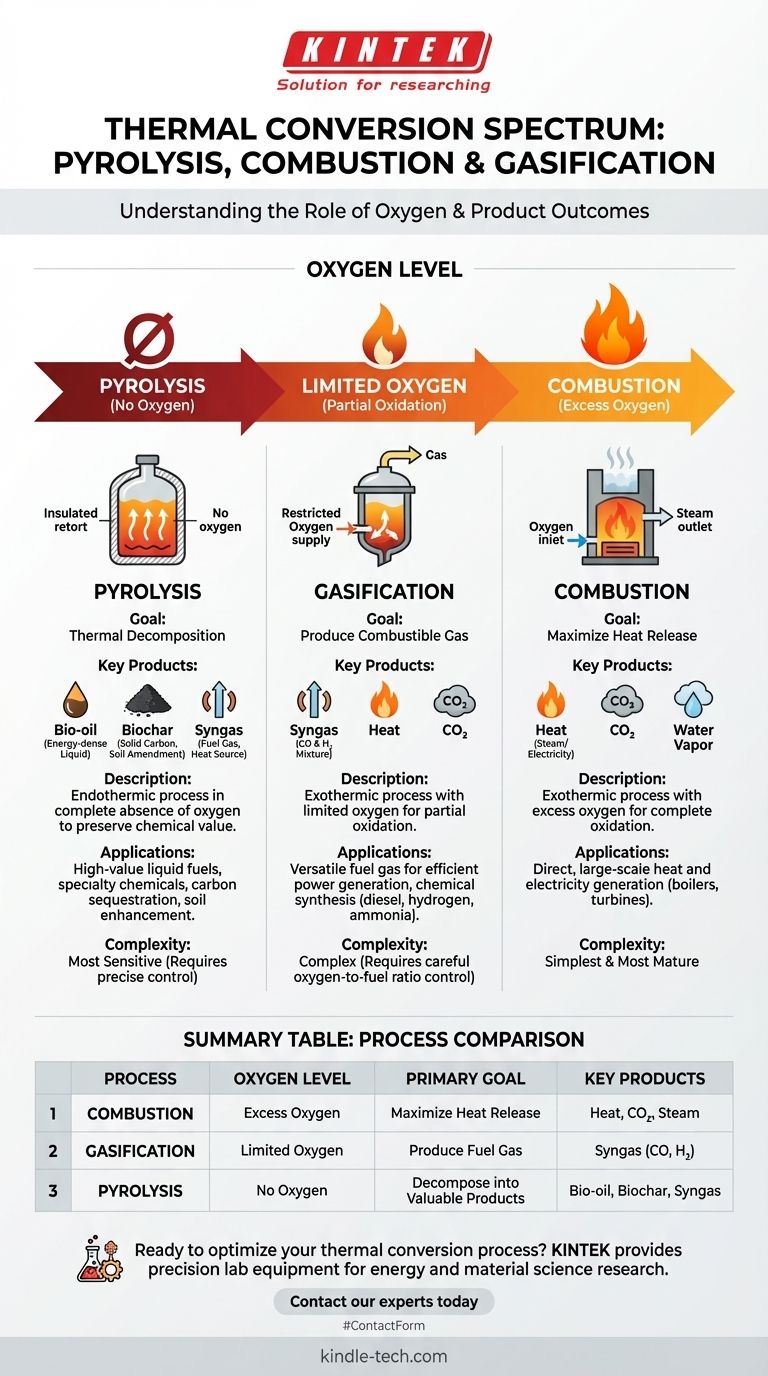
Im Kern liegt der Unterschied zwischen Pyrolyse, Verbrennung und Vergasung in der Menge an Sauerstoff, die während des thermischen Prozesses vorhanden ist. Die Verbrennung beinhaltet eine vollständige Oxidation in Gegenwart von überschüssigem Sauerstoff, um Wärme zu erzeugen. Die Vergasung verwendet eine begrenzte Menge Sauerstoff für eine partielle Oxidation, um ein brennbares Gas zu erzeugen. Die Pyrolyse hingegen findet in völliger Abwesenheit von Sauerstoff statt und nutzt Hitze, um Material in energiereiche Öle, Gase und Kohle zu zersetzen.
Obwohl alle drei thermische Umwandlungstechnologien sind, kommt es darauf an, sie nicht als isolierte Prozesse zu betrachten, sondern als Punkte auf einem Spektrum, das durch Sauerstoff gesteuert wird. Die Menge an zugeführtem Sauerstoff bestimmt direkt, ob Ihr primäres Ergebnis Wärme, Brenngas oder hochwertige chemische Produkte sind.

Die Rolle des Sauerstoffs: Ein Spektrum der Umwandlung
Das Verständnis dieser Technologien ist am einfachsten, wenn man sie als ein Kontinuum betrachtet, das auf dem Verhältnis von Sauerstoff zu Einsatzmaterial basiert. Jeder Prozess hat ein bestimmtes Ziel, das durch seine einzigartige chemische Umgebung vorgegeben ist.
Verbrennung: Vollständige Oxidation für maximale Wärme
Die Verbrennung ist der bekannteste Prozess, im Wesentlichen das schnelle Brennen von organischem Material. Sie arbeitet mit einem Überschuss an Sauerstoff.
Das Ziel hier ist einfach: Maximale Wärmeabgabe. Durch die Bereitstellung von mehr als ausreichend Sauerstoff wird der Brennstoff vollständig oxidiert und seine chemische Energie in thermische Energie, Kohlendioxid (CO₂) und Wasser umgewandelt.
Vergasung: Partielle Oxidation für Brenngas
Die Vergasung ist der Mittelweg. Sie entzieht der Reaktion absichtlich den Sauerstoff, der für eine vollständige Verbrennung erforderlich ist.
Durch die Verwendung nur einer begrenzten Menge Sauerstoff wird das organische Material nur teilweise oxidiert. Dieser Prozess erzeugt eine Mischung aus brennbaren Gasen, bekannt als Synthesegas oder Syngas (hauptsächlich Kohlenmonoxid und Wasserstoff), zusammen mit etwas CO₂ und Wärme.
Pyrolyse: Thermische Zersetzung ohne Sauerstoff
Die Pyrolyse befindet sich am Null-Sauerstoff-Ende des Spektrums. Es handelt sich nicht um einen Verbrennungsprozess, sondern um eine thermische Zersetzung, ähnlich dem „Kochen“ des Einsatzmaterials in einem versiegelten, sauerstofffreien Behälter.
Da kein Sauerstoff zur Reaktion vorhanden ist, zerfällt das Material in kleinere Moleküle. Dieser Prozess ist endotherm, was bedeutet, dass er eine konstante externe Wärmequelle erfordert. Er bewahrt die Energie des ursprünglichen Einsatzmaterials in wertvollen neuen Formen.
Vergleich der Ergebnisse und Anwendungen
Die unterschiedlichen chemischen Umgebungen führen zu stark unterschiedlichen Produkten, die jeweils ihre eigenen Anwendungsbereiche haben. Die Wahl des Prozesses hängt vollständig vom gewünschten Endprodukt ab.
Verbrennungsprodukte: Wärme und Strom
Das primäre Ergebnis der Verbrennung ist eine große Menge an Wärme. Diese Wärme wird am häufigsten zum Kochen von Wasser, zur Erzeugung von Dampf und zum Antreiben einer Turbine zur Stromerzeugung genutzt. Es ist der direkteste Weg von festem Brennstoff zu Energie.
Vergasungsprodukte: Syngas als vielseitiger Brennstoff
Das Hauptprodukt der Vergasung, Syngas, ist sehr flexibel. Es kann direkt in einem Gasmotor oder einer Turbine zur Stromerzeugung verbrannt werden, oft effizienter als bei direkter Verbrennung.
Alternativ kann Syngas als chemischer Baustein zur Synthese von Flüssigkraftstoffen (wie Diesel und Benzin), Wasserstoff oder wertvollen Chemikalien wie Methanol und Ammoniak dienen.
Pyrolyseprodukte: Bioöl und Biokohle
Die Pyrolyse zersetzt das Einsatzmaterial in drei Hauptprodukte:
- Bioöl (oder Pyrolyseöl): Eine dunkle, energiereiche Flüssigkeit, die zu Kraftstoffen für den Transport aufgerüstet oder zur Herstellung von Spezialchemikalien verwendet werden kann.
- Biokohle: Ein stabiler, kohlenstoffreicher Feststoff, der ein hervorragender Bodenverbesserer und ein wirksames Mittel zur Kohlenstoffabscheidung ist.
- Syngas: Ein gasförmiger Anteil, der zur Bereitstellung der Wärme genutzt werden kann, die für die Aufrechterhaltung der endothermen Pyrolyse selbst erforderlich ist.
Die Abwägungen verstehen
Die Wahl der richtigen Technologie erfordert die Anerkennung der inhärenten Kompromisse bei Komplexität, Effizienz und Handhabung der Einsatzmaterialien.
Prozesskomplexität und -steuerung
Die Verbrennung ist die einfachste und ausgereifteste der drei Technologien. Die Vergasung ist komplexer und erfordert eine sorgfältige Steuerung des Sauerstoff-Brennstoff-Verhältnisses, um die Syngasqualität zu maximieren.
Die Pyrolyse ist der empfindlichste Prozess. Sie erfordert eine absolut sauerstofffreie Umgebung und eine präzise Temperaturregelung, um die Verteilung der Endprodukte (Öl vs. Kohle vs. Gas) zu steuern.
Energiebilanz
Verbrennung und Vergasung sind exotherm – sie setzen Energie frei, sobald sie initiiert werden. Dies macht sie selbsterhaltend, solange Brennstoff und Sauerstoff zugeführt werden.
Die Pyrolyse ist als endotherm klassifiziert und erfordert eine kontinuierliche Energiezufuhr, um die Zersetzung voranzutreiben. Diese Energie wird oft durch die Verbrennung eines Teils des produzierten Syngases bereitgestellt, was die gesamte Nettoenergieausbeute des Systems beeinflusst.
Die richtige Wahl für Ihr Ziel treffen
Ihre endgültige Entscheidung muss mit Ihrem strategischen Ziel übereinstimmen.
- Wenn Ihr Hauptaugenmerk auf der direkten, großtechnischen Wärme- oder Stromerzeugung liegt: Die Verbrennung ist der etablierteste, kostengünstigste und direkteste Weg.
- Wenn Ihr Hauptaugenmerk auf der Herstellung eines vielseitigen Brenngases für effiziente Stromerzeugung oder chemische Synthese liegt: Die Vergasung bietet die notwendige Flexibilität, um feste Einsatzmaterialien in ein wertvolles gasförmiges Zwischenprodukt umzuwandeln.
- Wenn Ihr Hauptaugenmerk auf der Herstellung hochwertiger flüssiger Brennstoffe, Chemikalien oder kohlenstoffbindender Bodenprodukte liegt: Die Pyrolyse ist die optimale Wahl, da sie darauf ausgelegt ist, den chemischen Wert in ihren Materialausgaben zu erhalten.
Letztendlich beginnt die Beherrschung dieser Technologien mit dem Verständnis, dass Sauerstoff der grundlegende Schalter ist, der Ihr Endprodukt bestimmt.
Zusammenfassungstabelle:
| Prozess | Sauerstoffgehalt | Hauptziel | Schlüsselprodukte |
|---|---|---|---|
| Verbrennung | Überschüssiger Sauerstoff | Maximale Wärmeabgabe | Wärme, CO₂, Dampf |
| Vergasung | Begrenzter Sauerstoff | Erzeugung von Brenngas | Syngas (CO, H₂) |
| Pyrolyse | Kein Sauerstoff | Zersetzung in wertvolle Produkte | Bioöl, Biokohle, Syngas |
Bereit, Ihren thermischen Umwandlungsprozess zu optimieren? Ob Sie Wärme erzeugen, Syngas produzieren oder hochwertige Bio-Produkte herstellen – die Präzisionslaborausrüstung von KINTEK ist darauf ausgelegt, Ihre spezifischen Anforderungen zu erfüllen. Von Reaktoren bis hin zu Gasanalysatoren bieten wir zuverlässige Lösungen für Labore, die sich auf Energie- und Materialwissenschaften konzentrieren. Kontaktieren Sie noch heute unsere Experten, um zu besprechen, wie wir Ihre Forschungs- und Entwicklungsziele unterstützen können!
Visuelle Anleitung
Ähnliche Produkte
- Vakuumversiegelter kontinuierlich arbeitender Drehtiegelofen Rotierender Röhrenofen
- Elektrischer Drehrohrofen Kontinuierlicher Betrieb Kleine Drehrohrofen Heizpyrolyseanlage
- Elektrischer Drehrohrofen Kleiner Drehrohrofen Biomasse-Pyrolyseanlage
- Labor-Vakuum-Kipp-Drehrohröfen Drehrohröfen
- 1200℃ Spaltrohr-Ofen mit Quarzrohr Labor-Rohröfen
Andere fragen auch
- Welche Temperatur wird für die Pyrolyse von Abfällen benötigt? Ein Leitfaden zur Optimierung Ihres Waste-to-Value-Prozesses
- Wie steuern Hochtemperatur-Reaktionsöfen In-situ-MMCs? Beherrschung von Materialpräzision und struktureller Integrität
- Welche Ausrüstungsanforderungen gibt es für das Beladen von Platin (Pt) auf Verbundträger? Präzises Rühren für hohe Dispersion
- Was sind die Haupttypen von Biomasseumwandlungsprozessen? Entdecken Sie den besten Weg für Ihren Energiebedarf
- Was sind die Prozessvorteile der Verwendung eines Rotationsrohr-Ofens für WS2-Pulver? Überlegene Materialkristallinität erzielen



















