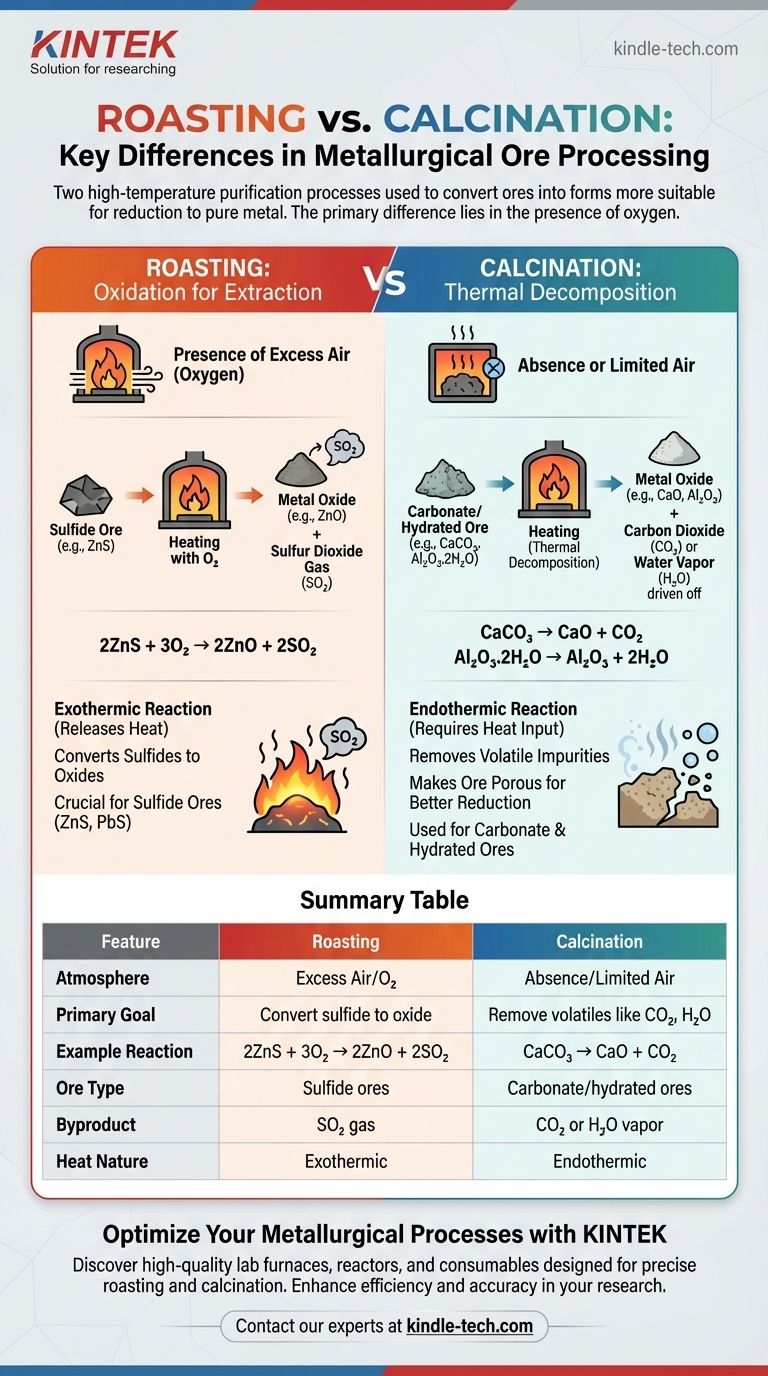
Im Wesentlichen liegt der Hauptunterschied zwischen Rösten und Kalzinieren in der Anwesenheit von Sauerstoff. Rösten ist der Prozess des Erhitzens eines konzentrierten Erzes auf eine hohe Temperatur in Gegenwart von überschüssiger Luft. Im Gegensatz dazu beinhaltet das Kalzinieren das Erhitzen eines Erzes auf eine hohe Temperatur entweder in Abwesenheit von Luft oder bei sehr begrenzter Zufuhr. Beide sind entscheidende Vorbereitungsschritte in der Metallurgie, die darauf abzielen, Erze in eine Form umzuwandeln, die für die Reduktion zum reinen Metall besser geeignet ist.
Obwohl beides Hochtemperatur-Reinigungsprozesse sind, nutzt das Rösten Sauerstoff, um Sulfiderze chemisch in Oxide umzuwandeln. Das Kalzinieren hingegen nutzt allein die Hitze, um Karbonat- oder hydratisierte Erze thermisch zu zersetzen und flüchtige Stoffe wie Kohlendioxid und Wasser auszutreiben.

Rösten verstehen: Oxidation zur Gewinnung
Das Rösten ist ein wichtiger pyrometallurgischer Prozess, was bedeutet, dass es Hitze nutzt, um chemische Veränderungen im Erz herbeizuführen. Seine Hauptanwendung findet es bei Sulfiderzen.
Das grundlegende Ziel
Der Hauptzweck des Röstens besteht darin, ein Metallsulfid in ein Metalloxid umzuwandeln. Metalloxide sind wesentlich einfacher und wirtschaftlicher zum reinen Metall zu reduzieren als ihre Sulfid-Pendants.
Die chemische Reaktion und ein Beispiel
Während des Röstens reagiert das Erz mit Sauerstoff aus der Luft. Dies wandelt das Metallsulfid in ein Metalloxid um und erzeugt Schwefeldioxid (SO₂) als Nebenprodukt.
Ein klassisches Beispiel ist das Rösten von Zinkblende (ZnS) zur Herstellung von Zinkoxid (ZnO), ein entscheidender Schritt bei der Zinkgewinnung:
2ZnS + 3O₂ → 2ZnO + 2SO₂
Wesentliche Merkmale des Röstens
Dieser Prozess wird in einem speziellen Ofen, wie einem Flammen- oder Herdoofen, bei einer Temperatur unterhalb des Schmelzpunkts des Erzes durchgeführt. Bei vielen Sulfiderzen ist die Reaktion exotherm, was bedeutet, dass sie Wärme freisetzt und sich nach dem Start selbst aufrechterhalten kann.
Kalzinieren verstehen: Thermische Zersetzung
Das Kalzinieren ist ein weiterer thermischer Behandlungsprozess, aber sein chemischer Mechanismus ist völlig anders. Es wird hauptsächlich für Karbonat- und hydratisierte Erze verwendet.
Das grundlegende Ziel
Das Ziel des Kalzinierens ist es, flüchtige Verunreinigungen durch Erhitzen des Erzes zu entfernen. Dadurch werden Stoffe wie Kohlendioxid (aus Karbonaten) oder Wasser (aus hydratisierten Oxiden) ausgetrieben, wodurch ein konzentrierteres Metalloxid zurückbleibt.
Die chemische Reaktion und ein Beispiel
Das Kalzinieren ist eine thermische Zersetzungsreaktion, die in Abwesenheit von Luft stattfindet. Ein Hauptbeispiel ist das Kalzinieren von Kalkstein (Calciumcarbonat, CaCO₃) zur Herstellung von Branntkalk (Calciumoxid, CaO):
CaCO₃ → CaO + CO₂
Eine weitere häufige Anwendung ist bei hydratisierten Erzen, wie Bauxit (hydratisiertes Aluminiumoxid), um Wasser vor dem Aluminiumgewinnungsprozess zu entfernen:
Al₂O₃.2H₂O → Al₂O₃ + 2H₂O
Wesentliche Merkmale des Kalzinierens
Dieser Prozess ist endotherm und erfordert eine kontinuierliche Wärmezufuhr. Er macht das Erz porös, was die Oberfläche für den anschließenden Reduktionsschritt vergrößert und somit dessen Effizienz steigert.
Abwägungen und Kontext verstehen
Die Wahl zwischen diesen Prozessen ist keine Frage der Präferenz; sie wird durch die Chemie des Erzes bestimmt. Das Verständnis dafür ist der Schlüssel zum Verständnis der Metallurgie.
Warum Sulfide nicht direkt reduziert werden?
Die direkte Reduktion von Metallsulfiden zu Metall ist thermodynamisch schwierig und teuer. Die vorherige Umwandlung in Oxide bietet einen weitaus effizienteren und kostengünstigeren Weg zur Reduktion, typischerweise unter Verwendung von Kohlenstoff (Koks) als Reduktionsmittel.
Umgang mit den Nebenprodukten
Das Rösten erzeugt Schwefeldioxid (SO₂), ein Gas, das bei Freisetzung in die Atmosphäre sauren Regen verursachen kann. Moderne metallurgische Anlagen fangen dieses Gas auf und verwenden es zur Herstellung von Schwefelsäure, wodurch eine potenzielle Umweltbelastung in ein wertvolles Handelsprodukt umgewandelt wird.
Die Bedeutung eines porösen Erzes
Die Fähigkeit des Kalzinierens, ein poröses, bröseliges Erz zu erzeugen, ist ein erheblicher Vorteil. Diese vergrößerte Oberfläche ermöglicht es dem Reduktionsmittel (wie Kohlenmonoxid in einem Hochofen), effektiver mit dem Metalloxid zu interagieren, was die endgültige Metallgewinnung beschleunigt.
Die richtige Wahl für Ihr Erz treffen
Die Wahl zwischen Rösten und Kalzinieren wird ausschließlich durch die chemische Zusammensetzung des zu verarbeitenden Erzes bestimmt.
- Wenn Ihr Erz ein Sulfid ist (wie Zinkblende, ZnS, oder Bleiglanz, PbS): Sie müssen rösten, um das Sulfid in ein Oxid umzuwandeln, bevor es zum reinen Metall reduziert werden kann.
- Wenn Ihr Erz ein Karbonat ist (wie Calamin, ZnCO₃, oder Kalkstein, CaCO₃): Sie müssen kalzinieren, um es thermisch zu zersetzen und Kohlendioxid auszutreiben, wodurch das Metalloxid entsteht.
- Wenn Ihr Erz ein hydratisiertes Oxid ist (wie Bauxit, Al₂O₃.2H₂O): Sie müssen kalzinieren, um das chemisch gebundene Wasser zu entfernen und ein reines, wasserfreies Oxid zu erzeugen.
Das Verständnis dieser grundlegenden Unterscheidung ist der erste Schritt zur Entwicklung eines effektiven und effizienten metallurgischen Gewinnungsprozesses.
Zusammenfassungstabelle:
| Merkmal | Rösten | Kalzinieren |
|---|---|---|
| Atmosphäre | Überschüssige Luft (Gegenwart von O₂) | Abwesenheit oder begrenzte Luft |
| Hauptziel | Umwandlung von Sulfiderzen in Oxide | Entfernung flüchtiger Verunreinigungen (CO₂, H₂O) |
| Beispielreaktion | 2ZnS + 3O₂ → 2ZnO + 2SO₂ | CaCO₃ → CaO + CO₂ |
| Erztyp | Sulfiderze (z. B. ZnS, PbS) | Karbonat-/hydratisierte Erze (z. B. CaCO₃, Bauxit) |
| Nebenprodukt | SO₂-Gas | CO₂- oder H₂O-Dampf |
| Wärmecharakter | Exotherm (setzt Wärme frei) | Endotherm (erfordert Wärmezufuhr) |
Optimieren Sie Ihre metallurgischen Prozesse mit KINTEK
Ob Sie Sulfiderze durch Rösten verarbeiten oder Karbonate durch Kalzinieren zersetzen, die richtige Laborausrüstung ist entscheidend für Effizienz und Genauigkeit. KINTEK ist spezialisiert auf die Bereitstellung hochwertiger Laboröfen, Reaktoren und Verbrauchsmaterialien, die den strengen Anforderungen metallurgischer Tests und Forschung gerecht werden.
Unsere Produkte gewährleisten präzise Temperaturkontrolle, gleichmäßige Erwärmung und Langlebigkeit – Schlüsselfaktoren für erfolgreiche Röst- und Kalzinierprozesse. Durch die Partnerschaft mit KINTEK erhalten Sie Zugang zu:
- Zuverlässige Ausrüstung, die die Prozessreproduzierbarkeit verbessert
- Fachkundige Unterstützung bei der Auswahl der richtigen Werkzeuge für Ihren spezifischen Erztyp
- Lösungen, die Sicherheit und Umweltkonformität verbessern
Bereit, Ihren Extraktionsprozess zu verfeinern? Kontaktieren Sie noch heute unsere Experten, um zu besprechen, wie die Laborausrüstung von KINTEK Ihre metallurgischen Innovationen unterstützen und Ihre Forschung voranbringen kann.
Visuelle Anleitung
Ähnliche Produkte
- Labor-Schnelltemperatur-Prozess (RTP) Quarzrohr-Ofen
- 1700℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
- Graphit-Vakuumofen Hochwärmeleitfähige Folien-Graphitierungsöfen
- 1700℃ Muffelofen für Labor
- Vakuumwärmebehandlungsöfen mit Keramikfaser-Auskleidung
Andere fragen auch
- Was ist die Funktion von Quarzrohren und Vakuumversiegelungssystemen? Sichern Sie Ihre Synthese hochreiner fester Lösungen
- Warum Quarzrohre und Vakuumversiegelung für Sulfid-Festkörperelektrolyte verwenden? Reinheit & Stöchiometrie sicherstellen
- Was sind die Hauptfunktionen von Hochpräzisions-Rohröfen beim Graphenwachstum? Fehlerfreie GS-Synthese erzielen
- Was passiert, wenn Quarz erhitzt wird? Ein Leitfaden zu seinen kritischen Phasenübergängen und Anwendungen
- Welche Rolle spielt eine Röhrenofen bei der Wärmebehandlung von Argyrodit-Elektrolyten? Beherrschen Sie die Ionenleitfähigkeit



















