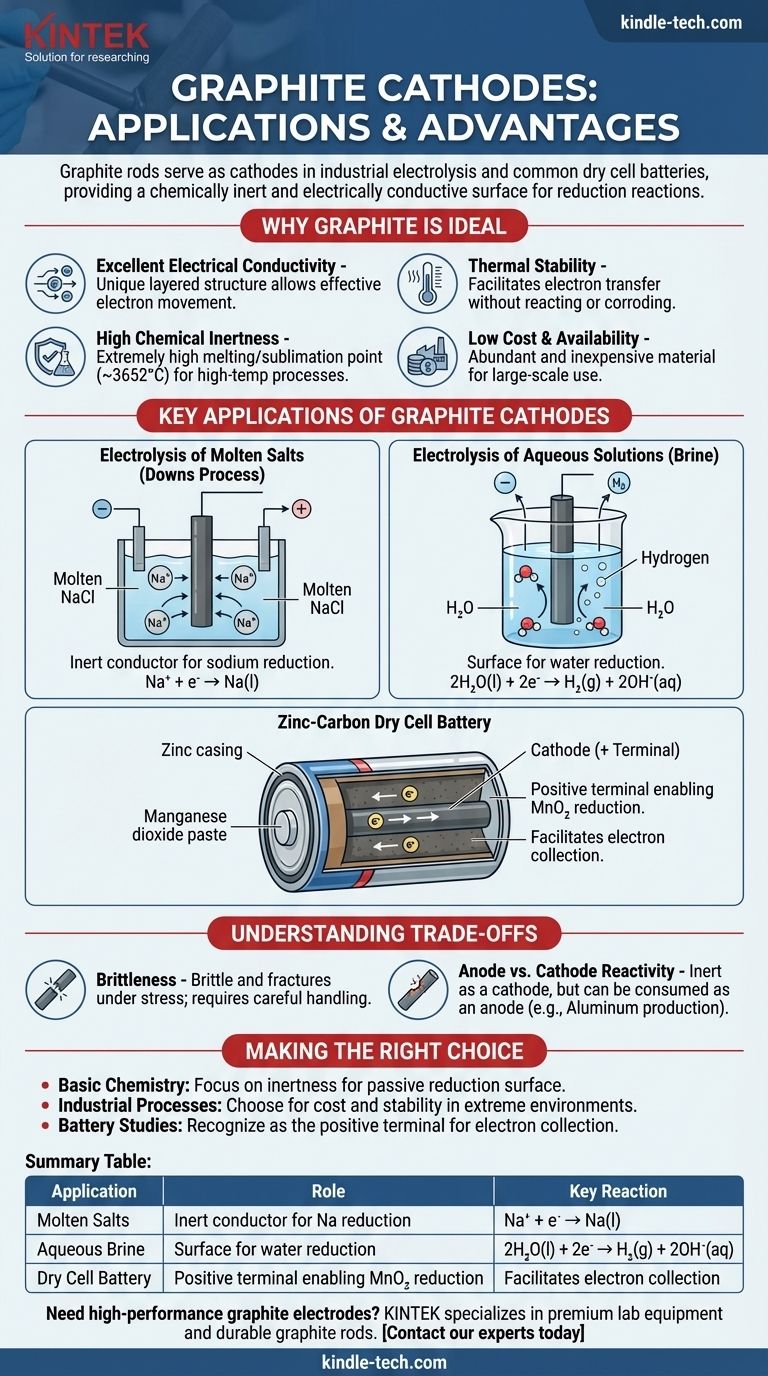
Graphitstäbe dienen als Kathoden in mehreren wichtigen elektrochemischen Prozessen, insbesondere bei der industriellen Elektrolyse von Salzen und in gängigen Trockenbatterien. In diesen Anwendungen besteht die Hauptfunktion des Graphitstabs nicht darin, verbraucht zu werden oder zu reagieren, sondern als chemisch inerte und elektrisch leitfähige Oberfläche zu fungieren, an der eine Reduktionsreaktion stattfinden kann.
Graphit wird als Kathodenmaterial gewählt, nicht weil es an der primären Reaktion teilnimmt, sondern weil es ein ausgezeichneter inerter Leiter ist. Seine einzigartige Kombination aus elektrischer Leitfähigkeit, chemischer Beständigkeit, hoher thermischer Stabilität und geringen Kosten macht es zu einer idealen Plattform für die Reduktionshalb-Reaktion.

Warum Graphit ein ideales Kathodenmaterial ist
Die Auswahl eines Materials für eine Elektrode ist eine kritische Designentscheidung in jeder elektrochemischen Zelle. Graphit (eine spezifische Form von Kohlenstoff) besitzt eine Reihe von Eigenschaften, die es außergewöhnlich gut für die Rolle einer Kathode geeignet machen.
Ausgezeichnete elektrische Leitfähigkeit
Graphit hat eine einzigartige geschichtete, planare Struktur. Innerhalb dieser Schichten können sich delokalisierte Elektronen frei bewegen, wodurch Graphit Elektrizität sehr effektiv leiten kann, eine notwendige Eigenschaft für jede Elektrode.
Hohe chemische Inertheit
Als Kathode muss die Elektrode den Elektronentransfer zu einer Substanz im Elektrolyten erleichtern, ohne selbst zu reagieren. Kohlenstoff ist relativ unreaktiv, insbesondere im Vergleich zu den meisten Metallen, was bedeutet, dass er nicht korrodiert oder den gewünschten chemischen Prozess stört.
Thermische Stabilität
Graphit hat einen der höchsten Schmelz-/Sublimationspunkte aller Elemente (ca. 3652°C oder 6606°F). Dies macht es perfekt für elektrochemische Hochtemperaturprozesse, wie die Elektrolyse von geschmolzenen Salzen, bei denen Metallelektroden schmelzen würden.
Geringe Kosten und Verfügbarkeit
Aus industrieller Sicht ist Graphit ein reichlich vorhandenes und kostengünstiges Material. Dies macht die großtechnische elektrochemische Produktion, die große Elektroden erfordert, wirtschaftlich machbar.
Schlüsselanwendungen von Graphitkathoden
Das Verständnis der spezifischen Anwendungsfälle verdeutlicht die Theorie. In jedem Beispiel ist die Graphitkathode einfach der Ort, an dem Elektronen geliefert werden, um eine chemische Veränderung zu bewirken.
Elektrolyse von geschmolzenen Salzen (Downs-Verfahren)
Bei der Herstellung von reinem Natriummetall aus geschmolzenem Natriumchlorid (NaCl) wird häufig ein Graphitstab als Kathode verwendet. Positiv geladene Natriumionen (Na⁺) werden von der negativ geladenen Kathode angezogen, wo sie ein Elektron aufnehmen und zu flüssigem Natriummetall reduziert werden.
Na⁺ + e⁻ → Na(l)
Die Graphitkathode stellt lediglich die Oberfläche und die Elektronen für diese Reaktion bereit.
Elektrolyse von wässrigen Lösungen (Sole)
Bei der Elektrolyse einer wässrigen Natriumchloridlösung (Sole) spielt die Graphitkathode eine ähnliche Rolle. In diesem Fall ist Wasser jedoch leichter zu reduzieren als Natriumionen.
Daher werden Wassermoleküle an der Oberfläche der Graphitkathode reduziert, wobei Wasserstoffgas und Hydroxidionen entstehen.
2H₂O(l) + 2e⁻ → H₂(g) + 2OH⁻(aq)
Die Zink-Kohle-Trockenbatterie
In einer gängigen "Heavy-Duty"-Batterie besteht der zentrale Stab aus Graphit und fungiert als Kathode (der positive Pol). Er ist von einer feuchten Paste aus Mangandioxid (MnO₂) und anderen Chemikalien umgeben.
Der Graphitstab sammelt Elektronen aus dem externen Stromkreis. Die Reduktionsreaktion findet in der Paste neben dem Stab statt, wo Mangandioxid reduziert wird. Der Graphit erleichtert diesen Prozess lediglich.
Die Kompromisse verstehen
Obwohl Graphit sehr effektiv ist, ist es kein perfektes Material. Das Erkennen seiner Grenzen ist der Schlüssel zum Verständnis seiner Anwendungen.
Sprödigkeit
Im Gegensatz zu Metallen, die duktil sind, ist Graphit spröde und kann unter mechanischer Beanspruchung oder Belastung brechen. Dies erfordert eine sorgfältige Handhabung und Unterstützung in industriellen Designs.
Anoden- vs. Kathodenreaktivität
Während Graphit als Kathode sehr inert ist, kann es verbraucht werden, wenn es als Anode (der Ort der Oxidation) in bestimmten Prozessen verwendet wird. Zum Beispiel reagiert bei der Aluminiumproduktion die Kohlenstoffanode mit dem entstehenden Sauerstoff zu CO₂-Gas und wird langsam abgetragen.
Verwechslung zwischen Zelltypen
Ein häufiger Verwechslungspunkt ist die Elektrodenpolarität. Die Kathode ist immer der Ort der Reduktion, aber ihr Vorzeichen ändert sich je nach Zelltyp.
- In einer Elektrolysezelle (wie bei der Salzelektrolyse) ist die Kathode der negative Pol.
- In einer galvanischen Zelle (wie einer Batterie) ist die Kathode der positive Pol.
Die richtige Wahl für Ihr Ziel treffen
Ihr Grund, nach Graphitkathoden zu fragen, bestimmt, welcher Aspekt am wichtigsten ist.
- Wenn Ihr Hauptaugenmerk auf der Grundlagenchemie liegt: Denken Sie daran, dass Graphit ein inerter Leiter ist, der eine passive Oberfläche für eine Reduktionsreaktion bietet, ohne selbst zu reagieren.
- Wenn Ihr Hauptaugenmerk auf industriellen Prozessen liegt: Wählen Sie Graphit wegen seiner Kosteneffizienz und unübertroffenen Stabilität in Hochtemperatur- oder korrosiven Umgebungen, in denen die meisten Metalle versagen würden.
- Wenn Ihr Hauptaugenmerk auf dem Studium von Batterien liegt: Erkennen Sie, dass der Graphitstab in einer Zink-Kohle-Zelle als positiver Pol (Kathode) fungiert und als Elektronensammler dient, der die Reduktion der umgebenden chemischen Paste ermöglicht.
Letztendlich geht es beim Verständnis der Rolle von Graphit als Kathode darum, die Kraft eines inerten, leitfähigen Materials zu erkennen, das die Chemie ermöglicht, ohne sie zu stören.
Zusammenfassungstabelle:
| Anwendung | Rolle der Graphitkathode | Schlüsselreaktion |
|---|---|---|
| Elektrolyse von geschmolzenen Salzen (Downs-Verfahren) | Inerter Leiter für die Natriumreduktion | Na⁺ + e⁻ → Na(l) |
| Elektrolyse von wässriger Sole | Oberfläche für die Wasserreduktion | 2H₂O(l) + 2e⁻ → H₂(g) + 2OH⁻(aq) |
| Zink-Kohle-Trockenbatterie | Positiver Pol, der die MnO₂-Reduktion ermöglicht | Erleichtert die Elektronensammlung |
Benötigen Sie Hochleistungs-Graphitelektroden für Ihre elektrochemischen Prozesse? KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien, einschließlich langlebiger Graphitstäbe, die für überragende Leitfähigkeit und thermische Stabilität entwickelt wurden. Ganz gleich, ob Sie industrielle Elektrolyse betreiben oder Batterietechnologien entwickeln, unsere Materialien gewährleisten eine zuverlässige, inerte Leistung. Kontaktieren Sie noch heute unsere Experten, um die perfekte Graphitlösung für Ihre Laboranforderungen zu finden!
Visuelle Anleitung
Ähnliche Produkte
- Isostatisch gepresste Graphit-Kohlenstoffplatte
- Elektrodenpolier-Material für elektrochemische Experimente
- Graphit-Vakuumofen Hochwärmeleitfähige Folien-Graphitierungsöfen
- Vertikaler Hochtemperatur-Graphit-Vakuum-Graphitierungs-Ofen
- Großer vertikaler Graphit-Vakuumgraphitierungs-Ofen
Andere fragen auch
- Leitet Graphit Strom? Die Geheimnisse seiner Atomstruktur entschlüsselt
- Ist Graphit ein leitfähiges Metall? Entdecken Sie, warum dieser Nichtmetall moderne Technologie antreibt
- Was sind die Eigenschaften von Graphit? Entdecken Sie hochfeste Festigkeit und Leitfähigkeit bei hohen Temperaturen
- Was ist die Funktion von Graphitmaterial bei der Herstellung von Ga-LLZO-Sinterkörpern? Sicherstellung der Probenintegrität in HIP
- Was sind die Vorteile von Biomasse? Erschließen Sie erneuerbare Energie aus Abfällen und Pflanzen



















