In der Infrarot-Spektroskopie (IR) steuert die Konzentration direkt die Intensität der Absorptionsbanden. Eine höhere Konzentration eines Analyten in einer Probe führt zu einer stärkeren Absorption von IR-Strahlung bei seinen charakteristischen Frequenzen. Dies bewirkt, dass die entsprechenden Peaks im IR-Spektrum höher und ausgeprägter werden, eine Beziehung, die mathematisch durch das Beer-Lambert-Gesetz beschrieben wird.
Die Beziehung zwischen Konzentration und IR-Absorption ist für die quantitative Analyse sehr nützlich, aber nicht in allen Situationen perfekt linear. Das Verständnis ihrer praktischen Grenzen, wie z. B. Detektorsättigung bei hohen Konzentrationen und intermolekulare Effekte, ist entscheidend für eine genaue Spektralinterpretation und Messung.
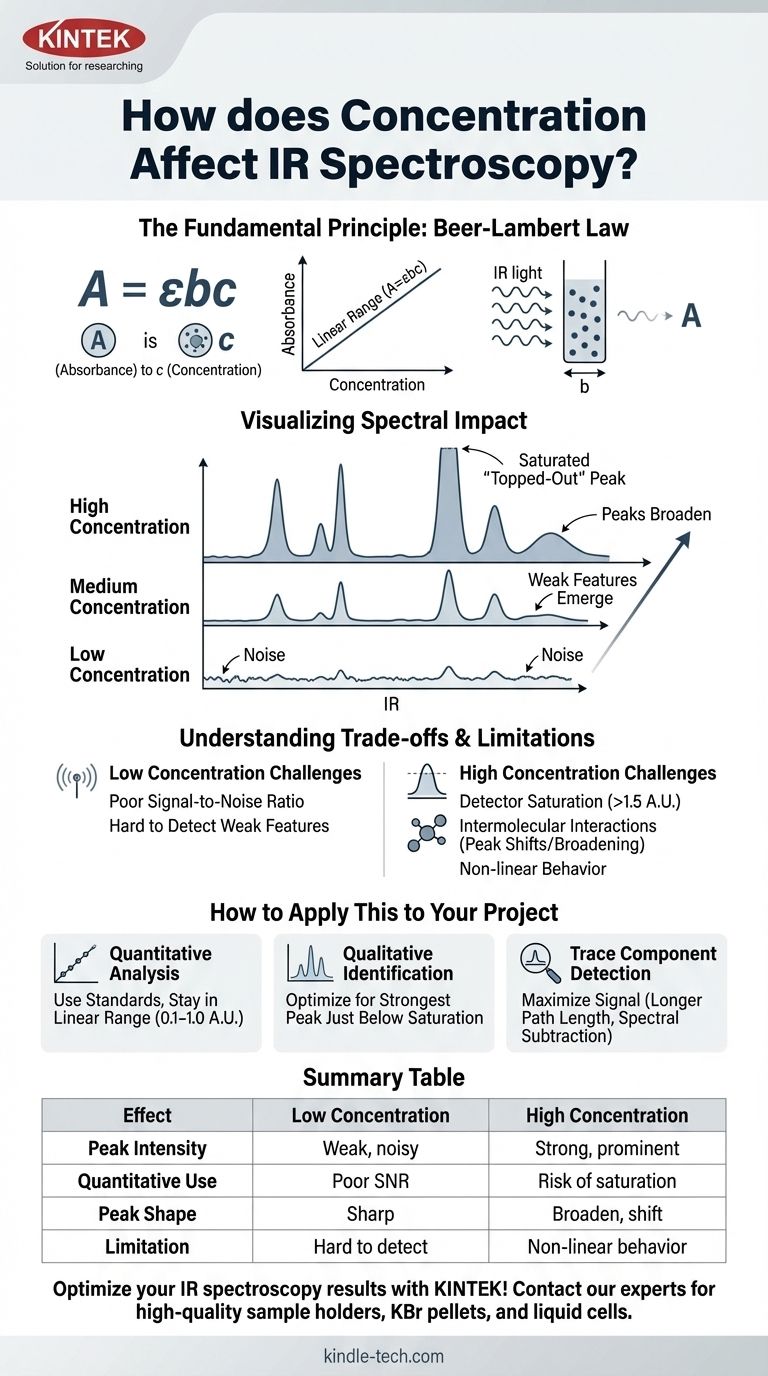
Das Grundprinzip: Das Beer-Lambert-Gesetz
Die Verbindung zwischen Konzentration und Absorption ist der Eckpfeiler der quantitativen Spektroskopie. Sie liefert ein vorhersagbares Modell dafür, wie Licht mit Materie interagiert.
Definition der Gleichung (A = εbc)
Das Beer-Lambert-Gesetz wird als A = εbc ausgedrückt.
- A ist die Absorption (dimensionslos).
- ε (Epsilon) ist die molare Absorptivität, eine intrinsische Eigenschaft des Moleküls bei einer bestimmten Wellenlänge.
- b ist die Schichtdicke des Probenhalters (z. B. die Dicke einer Flüssigkeitszelle), üblicherweise in cm.
- c ist die Konzentration des Analyten.
Diese Gleichung zeigt, dass die Absorption direkt proportional zur Konzentration ist, wenn die Schichtdicke und die molare Absorptivität konstant sind.
Absorption vs. Transmission
IR-Instrumente messen physikalisch die Transmission (%T), den Anteil des Lichts, der die Probe durchdringt. Analysten arbeiten jedoch fast immer mit der Absorption (A).
Die beiden sind durch die Formel A = -log(T) miteinander verbunden. Das Auftragen der Absorption gegen die Konzentration ergibt eine gerade Linie, die für die Analyse weitaus nützlicher ist als die exponentielle Kurve, die durch die Transmission erzeugt wird.
Visualisierung des spektralen Einflusses
Wenn Sie die Konzentration einer Substanz erhöhen:
- Peaks werden höher: Die Absorptionswerte für alle Peaks nehmen zu.
- Schwache Merkmale treten hervor: Kleine Peaks, die bei niedrigen Konzentrationen im Grundrauschen verloren gingen, werden sichtbar.
- Starke Peaks verbreitern sich: Sehr intensive Absorptionsbanden werden nicht nur höher, sondern auch breiter.
Verständnis der Kompromisse und Einschränkungen
Das Beer-Lambert-Gesetz beschreibt ein ideales Szenario. In der Praxis können mehrere Faktoren zu Abweichungen von dieser linearen Beziehung führen, insbesondere bei hohen Konzentrationen.
Das Problem der "übersteuerten" Peaks
Wenn die Konzentration zu hoch ist, kann ein Peak so intensiv werden, dass er fast das gesamte Licht bei dieser Frequenz absorbiert. Die Absorption kann den optimalen Bereich des Detektors überschreiten (typischerweise > 1,5 A.U.).
Dies führt dazu, dass der Peak abgeflacht oder "abgeschnitten" an der Spitze erscheint. Alle quantitativen Informationen in diesem gesättigten Peak gehen verloren, da das Instrument die wahre Absorption nicht mehr genau messen kann.
Intermolekulare Wechselwirkungen
Bei hohen Konzentrationen liegen Moleküle näher beieinander und können miteinander wechselwirken. Ein klassisches Beispiel ist die Wasserstoffbrückenbindung in Alkoholen oder Carbonsäuren.
Diese Wechselwirkungen können die Schwingungsenergie der Bindungen verändern, wodurch Peaks ihre Position verschieben, ihre Form ändern oder sich verbreitern. Dies ändert die molare Absorptivität (ε) und durchbricht die einfache lineare Beziehung zwischen Absorption und Konzentration.
Instrumentelle Effekte
Kein Instrument ist perfekt. Eine geringe Menge an Streulicht kann den Detektor erreichen, ohne die Probe zu durchdringen. Dies führt dazu, dass die Absorptionswerte bei hohen Konzentrationen ein Plateau erreichen, was zu einer Kurve führt, die sich zur x-Achse hin biegt, anstatt linear zu bleiben.
Die Herausforderung niedriger Konzentrationen
Umgekehrt, wenn eine Probe zu verdünnt ist, kann die Absorption zu gering sein, um sie vom instrumentellen Grundrauschen zu unterscheiden. Das schlechte Signal-Rausch-Verhältnis macht sowohl die qualitative Identifizierung als auch die quantitative Messung unzuverlässig.
Wie Sie dies in Ihrem Projekt anwenden können
Ihre Herangehensweise an die Probenkonzentration hängt vollständig von Ihrem analytischen Ziel ab. Sie müssen Ihre Probe so vorbereiten, dass das Spektrum für Ihren spezifischen Zweck optimiert ist.
- Wenn Ihr Hauptaugenmerk auf der quantitativen Analyse liegt: Bereiten Sie eine Reihe von Standards vor und erstellen Sie eine Kalibrierkurve, um sicherzustellen, dass die Absorption Ihrer unbekannten Probe in den linearen Bereich Ihrer Kurve fällt (typischerweise 0,1–1,0 A.U.).
- Wenn Ihr Hauptaugenmerk auf der qualitativen Identifizierung liegt: Passen Sie Ihre Probenvorbereitung an (z. B. Menge in einem KBr-Pellet, Schichtdicke einer Flüssigkeitszelle), um ein Spektrum zu erhalten, bei dem der stärkste Peak knapp unterhalb der Sättigung liegt, um sicherzustellen, dass schwächere funktionelle Gruppenbanden deutlich sichtbar sind.
- Wenn Ihr Hauptaugenmerk auf dem Nachweis einer Spurenkomponente liegt: Verwenden Sie Techniken, die das Signal des Analyten maximieren, z. B. die Verwendung von Zellen mit längeren Schichtdicken oder die Durchführung einer Spektralsubtraktion, um Interferenzen durch ein Lösungsmittel oder eine Matrix zu entfernen.
Letztendlich ist die Kontrolle und das Verständnis der Konzentration der Schlüssel, um ein IR-Spektrum von einem einfachen Fingerabdruck in ein präzises Analysewerkzeug zu verwandeln.
Zusammenfassungstabelle:
| Auswirkung der Konzentration | Niedrige Konzentration | Hohe Konzentration |
|---|---|---|
| Peak-Intensität | Schwache, verrauschte Peaks | Starke, ausgeprägte Peaks |
| Quantitative Nutzung | Schlechtes Signal-Rausch-Verhältnis | Risiko der Detektorsättigung |
| Peak-Form | Scharf, gut definiert | Kann sich verbreitern und verschieben |
| Wesentliche Einschränkung | Schwer zu erkennen | Nicht-lineares Beer-Lambert-Verhalten |
Optimieren Sie Ihre IR-Spektroskopie-Ergebnisse mit KINTEK!
Ganz gleich, ob Sie präzise quantitative Analysen durchführen oder eine zuverlässige qualitative Identifizierung benötigen, die richtige Probenvorbereitung ist entscheidend. KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien, einschließlich IR-Probenhalter, KBr-Pellets und Flüssigkeitszellen, die Ihnen helfen, optimale Konzentration und Schichtdicke für klare, genaue Spektren zu erreichen.
Kontaktieren Sie noch heute unsere Experten, um Ihre spezifischen Laboranforderungen zu besprechen und herauszufinden, wie unsere Lösungen Ihren Spektroskopie-Workflow und die Datenzuverlässigkeit verbessern können.
Visuelle Anleitung
Ähnliche Produkte
- Iridiumdioxid IrO2 für die Wasserelektrolyse
- Hochwiderstandsfähige Einkristall-Siliziumlinse für Infrarot
- Graphit-Vakuumofen IGBT Experimenteller Graphitierungsherd
- Infrarot-Transmissionsbeschichtete Saphirplattensubstratfenster
- Optisches Fensterglas Substratwaferplatten Zinksulfid ZnS Fenster
Andere fragen auch
- Wie lange dauert Löten? Ein Leitfaden zu Zeitplanung und Technik für perfekte Lötstellen
- Nach welchem Prinzip funktioniert die Magnetron-Sputter-Beschichtung? Erzielen Sie hochwertige Dünnschichten mit Präzision
- Wie funktioniert das Magnetronsputtern? Eine Schritt-für-Schritt-Anleitung zur Dünnschichtabscheidung
- Was ist die Delta-20-Regel der Verdunstung? Sicher und effektiv sprühen lernen
- Was sind die Vorteile der Pyrolyse von Kunststoff? Wert aus Abfall für eine Kreislaufwirtschaft erschließen
- Was sind die zwei Arten des Sinterns? Festkörper- vs. Flüssigphasensintern erklärt
- Wofür wird Sintermetall verwendet? Von Autoteilen bis hin zu medizinischen Implantaten
- Wie hoch ist die Effizienz der Biomasse-zu-Strom-Umwandlung? Erreichen Sie 20-40% elektrische & 80%+ Gesamteffizienz
















