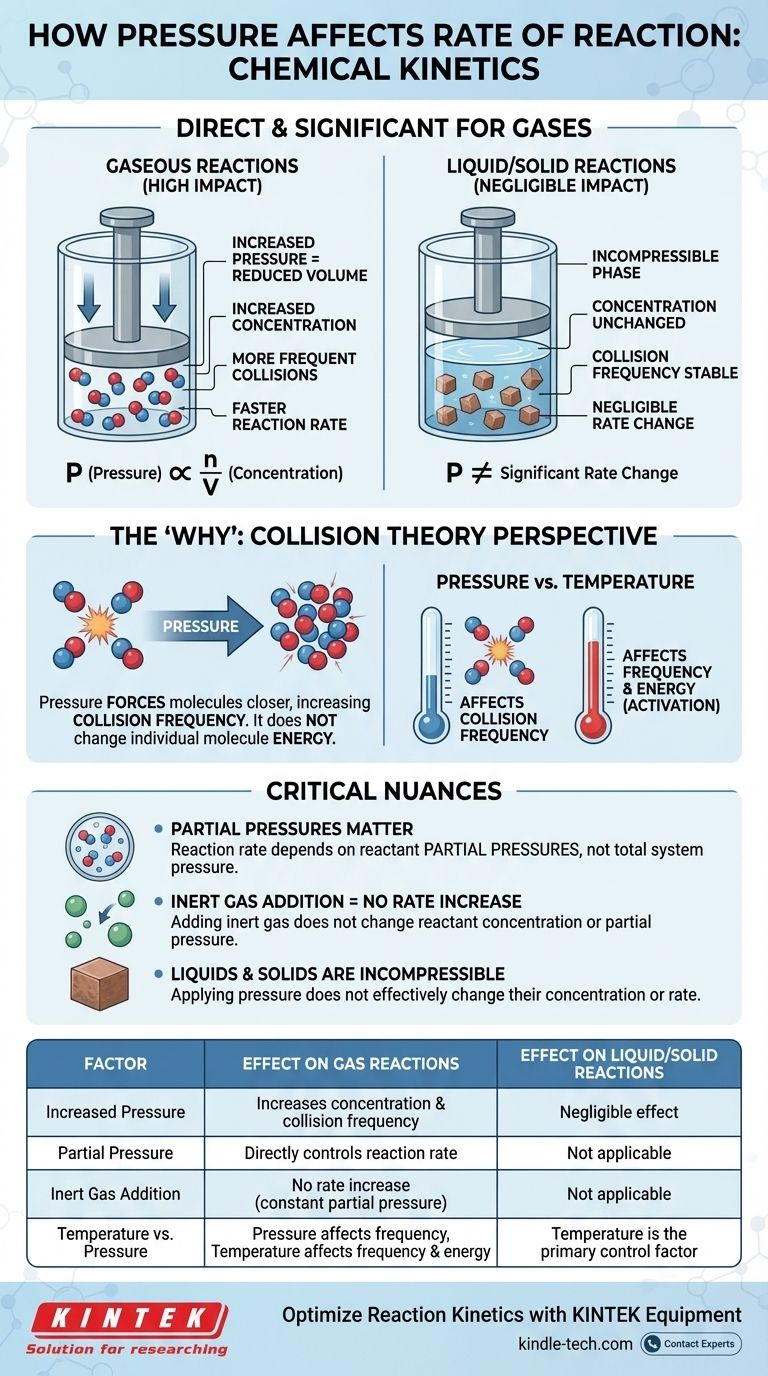
In der chemischen Kinetik ist der Einfluss des Drucks auf die Reaktionsgeschwindigkeit direkt und signifikant, aber nur bei Reaktionen, an denen Gase beteiligt sind. Bei einer Gasreaktion erhöht eine Druckerhöhung die Konzentration der Reaktantenmoleküle. Dies führt zu häufigeren Kollisionen zwischen ihnen, was wiederum die Gesamtgeschwindigkeit der Reaktion erhöht. Bei Reaktionen, die rein in flüssiger oder fester Phase ablaufen, hat der Druck nur einen vernachlässigbaren Einfluss auf die Geschwindigkeit.
Die Beziehung zwischen Druck und Reaktionsgeschwindigkeit ist im Grunde eine Geschichte über Konzentration. Bei Gasen ist die Druckerhöhung lediglich ein physikalisches Mittel, um mehr Moleküle in dasselbe Volumen zu zwingen, wodurch die Häufigkeit effektiver Kollisionen erhöht und somit die Reaktion beschleunigt wird.

Der grundlegende Zusammenhang: Druck als Stellvertreter für die Konzentration
Der Hauptgrund, warum Druck Gasreaktionen beeinflusst, liegt in seinem direkten Zusammenhang mit der Konzentration. Dieses Prinzip lässt sich am besten anhand der grundlegenden Gesetze der Chemie erklären.
Die Rolle des idealen Gasgesetzes
Das ideale Gasgesetz, PV = nRT, liefert die mathematische Verbindung. Wenn wir es umstellen, um nach dem Druck (P = (n/V)RT) aufzulösen, sehen wir, dass der Druck (P) direkt proportional zu n/V ist.
Der Term n/V repräsentiert Mol (n) pro Volumeneinheit (V), was die genaue Definition der molaren Konzentration ist. Wenn Sie also bei konstanter Temperatur den Druck eines Systems erhöhen, erhöhen Sie direkt die Konzentration der Gasmoleküle darin.
Wie die Konzentration die Reaktionsgeschwindigkeit bestimmt
Die Geschwindigkeit einer Reaktion wird durch ihr Geschwindigkeitsgesetz definiert, das oft als rate = k[A]^m[B]^n ausgedrückt wird. In dieser Gleichung stellen [A] und [B] die Konzentrationen der Reaktanten dar.
Das Geschwindigkeitsgesetz zeigt, dass die Reaktionsgeschwindigkeit direkt von der Konzentration ihrer Reaktanten abhängt. Eine höhere Konzentration bedeutet eine schnellere Rate. Wenn man dies mit dem Gasgesetz verknüpft, wird die Kette der Ereignisse klar: Erhöhter Druck erhöht die Konzentration, was wiederum die Reaktionsgeschwindigkeit erhöht.
Das „Warum“ hinter der Änderung: Eine Perspektive der Stoßtheorie
Geschwindigkeitsgesetze sagen uns, was passiert, aber die Stoßtheorie erklärt, warum es auf molekularer Ebene geschieht. Damit eine Reaktion stattfinden kann, müssen Reaktantenpartikel mit sowohl ausreichender Energie als auch der korrekten Orientierung kollidieren.
Das Prinzip der Kollisionshäufigkeit
Eine chemische Reaktion ist das Ergebnis unzähliger molekularer Kollisionen. Je mehr Kollisionen pro Sekunde stattfinden, desto mehr Möglichkeiten gibt es für eine erfolgreiche Reaktion.
Wie Druck die Kollisionen steigert
Die Druckerhöhung eines Gases verringert das Volumen, das es einnimmt, und zwingt die Moleküle näher zusammen. Dies erhöht dramatisch ihre Kollisionshäufigkeit – die Anzahl der Male, die sie pro Zeiteinheit miteinander zusammenstoßen.
Während der Druck die Energie einzelner Moleküle nicht verändert (das ist die Aufgabe der Temperatur), vervielfacht er die Anzahl der gesamten Kollisionsereignisse. Diese Zunahme der Häufigkeit führt zu einer proportionalen Zunahme erfolgreicher, reaktionsauslösender Kollisionen.
Nuancen und Kompromisse verstehen
Obwohl die allgemeine Regel gilt, muss ein Experte die spezifischen Bedingungen verstehen, unter denen sie zutrifft, und vor allem, wann sie nicht zutrifft.
Die entscheidende Rolle der Partialdrücke
In einem Gasgemisch hängt die gesamte Reaktionsgeschwindigkeit von den Partialdrücken der spezifischen Reaktanten ab, nicht vom Gesamtdruck des Systems. Der Partialdruck ist der Druck, den ein einzelnes Gas ausüben würde, wenn es das gesamte Volumen allein einnehmen würde.
Das bedeutet, Sie können den Gesamtdruck erhöhen, indem Sie ein inertgas (wie Argon oder Stickstoff) in den Reaktionsbehälter einbringen. Da dies jedoch die Konzentration oder den Partialdruck der tatsächlichen Reaktanten nicht ändert, wird es die Reaktionsgeschwindigkeit nicht erhöhen.
Die unbedeutende Wirkung auf Flüssigkeiten und Feststoffe
Druck hat nur einen geringfügigen Einfluss auf die Reaktionsgeschwindigkeiten in kondensierten Phasen (Flüssigkeiten und Feststoffe). Diese Aggregatzustände gelten bereits als inkompressibel.
Die Moleküle in Flüssigkeiten und Feststoffen sind bereits dicht gepackt. Das Anlegen von äußerem Druck verringert den Abstand zwischen ihnen oder ändert ihre Konzentration nicht wesentlich. Daher ist es kein wirksames Mittel zur Änderung ihrer Reaktionsgeschwindigkeiten.
Druck vs. Temperatur
Es ist entscheidend, die Auswirkungen von Druck und Temperatur zu unterscheiden.
- Druck beeinflusst hauptsächlich die Häufigkeit von Kollisionen.
- Temperatur beeinflusst sowohl die Häufigkeit von Kollisionen (Moleküle bewegen sich schneller) als auch, was noch wichtiger ist, die Energie jeder Kollision.
Die Erhöhung der Temperatur steigert den Anteil der Moleküle, die die minimal erforderliche Aktivierungsenergie besitzen, was sie zu einem weitaus stärkeren Faktor zur Erhöhung der Reaktionsgeschwindigkeiten macht als der Druck.
Die richtige Wahl für Ihr System treffen
Das Verständnis dieses Prinzips ermöglicht es Ihnen, Reaktionsergebnisse basierend auf Ihren spezifischen Zielen zu steuern. Berücksichtigen Sie Folgendes bei der Entwicklung oder Optimierung eines chemischen Prozesses.
- Wenn Ihr Hauptaugenmerk darauf liegt, die Geschwindigkeit einer Gasreaktion zu maximieren: Die Erhöhung des Systemdrucks durch Volumenreduzierung ist eine direkte und effektive Methode zur Steigerung des Durchsatzes.
- Wenn Ihr Hauptaugenmerk darauf liegt, eine Reaktion in einem Gasgemisch zu steuern: Sie müssen die Partialdrücke der Reaktanten steuern, da das bloße Hinzufügen eines Inertgases zur Erhöhung des Gesamtdrucks Ihre Zielreaktion nicht beschleunigt.
- Wenn Ihr Hauptaugenmerk darauf liegt, die Geschwindigkeit einer Reaktion in einer Flüssigkeit oder einem Feststoff zu verändern: Die Beeinflussung des Drucks ist keine praktikable Strategie; Sie sollten sich darauf konzentrieren, die Temperatur, die Konzentration gelöster Spezies oder einen Katalysator zu ändern.
Indem Sie verstehen, dass Druck ein Stellvertreter für die Konzentration bei Gasen ist, erlangen Sie präzise Kontrolle über die Kinetik Ihres Systems.
Zusammenfassungstabelle:
| Faktor | Auswirkung auf Gasreaktionen | Auswirkung auf Flüssig-/Feststoffreaktionen |
|---|---|---|
| Erhöhter Druck | Erhöht Konzentration & Kollisionshäufigkeit | Vernachlässigbare Wirkung (inkompressibel) |
| Partialdruck | Steuert die Reaktionsgeschwindigkeit direkt | Nicht anwendbar |
| Zugabe von Inertgas | Keine Geschwindigkeitssteigerung (konstanter Partialdruck) | Nicht anwendbar |
| Temperatur vs. Druck | Druck beeinflusst die Häufigkeit; Temperatur beeinflusst Häufigkeit & Energie | Temperatur ist der primäre Steuerungsfaktor |
Müssen Sie Ihre chemischen Reaktionen präzise steuern? KINTEK ist spezialisiert auf hochwertige Laborgeräte, einschließlich Druckreaktoren und Gasbehandlungssysteme, um Ihnen bei der Optimierung der Reaktionskinetik und der Erzielung hervorragender Ergebnisse in Ihrem Labor zu helfen. Kontaktieren Sie noch heute unsere Experten, um Ihre spezifische Anwendung zu besprechen und die richtige Lösung für Ihre Bedürfnisse zu finden.
Visuelle Anleitung
Ähnliche Produkte
- Anpassbare Hochdruckreaktoren für fortschrittliche wissenschaftliche und industrielle Anwendungen
- Mini-Hochdruck-Autoklavreaktor aus Edelstahl für Laboranwendungen
- Edelstahl-Hochdruck-Autoklav-Reaktor Labor-Druckreaktor
- Hochdruck-Laborautoklav-Reaktor für Hydrothermalsynthese
- Elektrische Labor-Kaltisostatische Presse CIP-Maschine für Kaltisostatisches Pressen
Andere fragen auch
- Was sind die technischen Vorteile der Verwendung eines Alkalischmelzreaktors? Erhaltung der Zugfestigkeit von Kohlefaser
- Was macht ein Hochdruckregelventil? Ein Leitfaden zur Beherrschung extremer Fluidenergien
- Welche Ausrüstung wird für die hydrothermale Synthese von Ga0.25Zn4.67S5.08 benötigt? Optimieren Sie Ihre Halbleiterproduktion
- Wie schützt ein SHS-Reaktor ZrB2–MoSi2-Pulver? Gewährleistung einer hochreinen Synthese und Oxidationsbeständigkeit
- Welche Rollen spielen keramische Träger in nickelbasierten Katalysatoren? Verbesserung der Stabilität von Reformerreaktoren
- Welche Rolle spielt ein Hochdruckreaktor mit PTFE-Auskleidung bei der SnS2-Synthese? Verbesserung der Nanosheet-Morphologie
- Wie unterstützt ein Hochdruckreaktor die Carbonatisierung von ESBO zu CSBO? Master Hochdruck-Synthesechemie
- Welche Rolle spielen Hochdruckreaktoren beim Testen der Korrosion von Edelstahl? Bewertung von SCC unter extremen Bedingungen



















