Im Wesentlichen ist die Kalzinierung ein durch Wärme angetriebener Reinigungs- und Umwandlungsprozess. Es handelt sich um eine spezielle Art der Wärmebehandlung, die auf feste Materialien angewendet wird, wobei diese auf eine hohe Temperatur, aber unterhalb ihres Schmelzpunktes erhitzt werden. Dies geschieht in Abwesenheit oder mit einer sehr begrenzten Luftzufuhr, was ein entscheidendes Detail ist, das sie von anderen thermischen Prozessen unterscheidet. Die Hauptziele sind die Induzierung einer thermischen Zersetzung, das Austreiben flüchtiger Substanzen wie Wasser oder Kohlendioxid oder die Auslösung einer Änderung der Kristallstruktur des Materials.
Kalzinierung ist nicht einfach nur das Erhitzen eines Materials; es ist ein präziser thermischer Prozess, der darauf ausgelegt ist, die chemische Zusammensetzung oder physikalische Struktur eines Materials zu verändern, ohne es zu schmelzen. Der Schlüssel liegt in der Kontrolle von Temperatur und Atmosphäre, um ein spezifisches Ergebnis wie Zersetzung oder Reinigung zu erzielen.

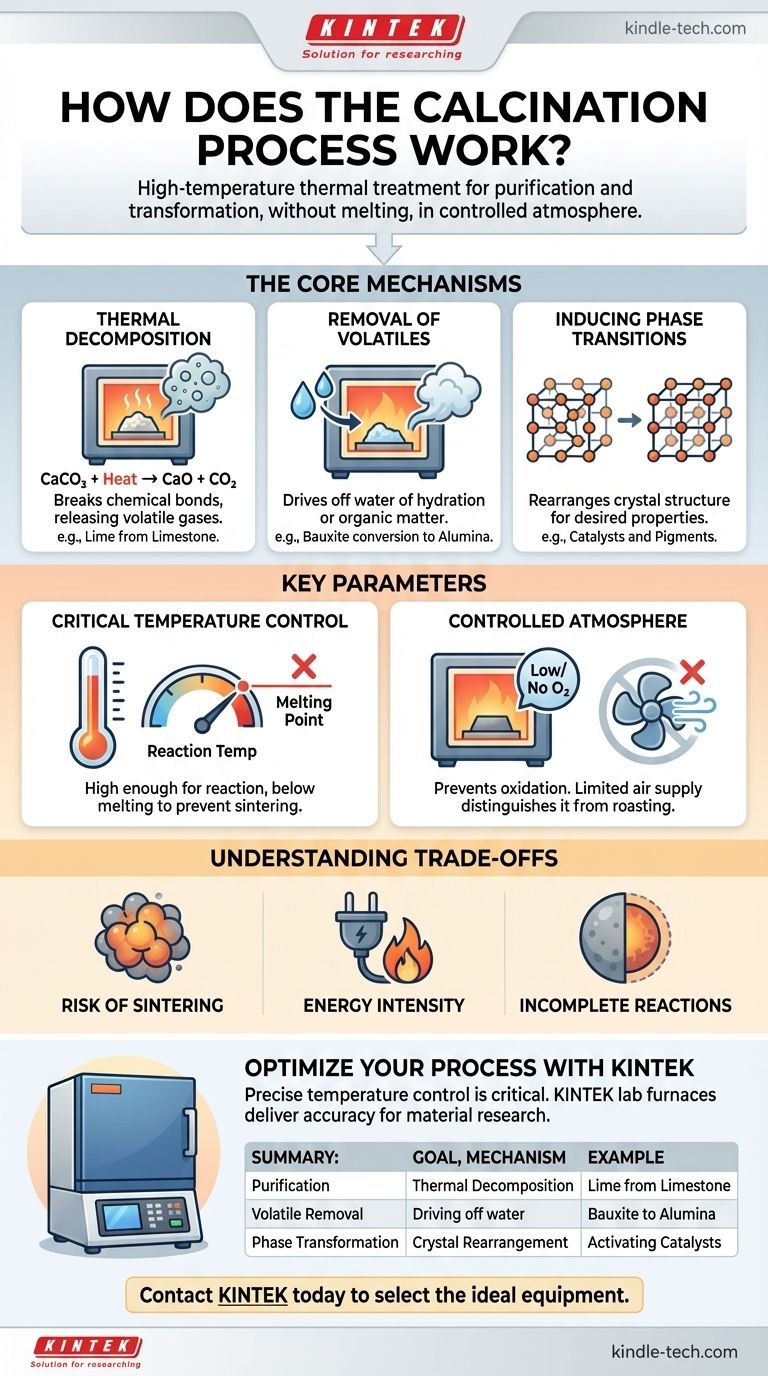
Die Kernmechanismen der Kalzinierung
Die Kalzinierung erzielt ihre Ergebnisse durch mehrere unterschiedliche physikalische und chemische Veränderungen. Das spezifische Ziel des Prozesses bestimmt, welcher dieser Mechanismen am wichtigsten ist.
Thermische Zersetzung
Dies ist das häufigste Ziel der Kalzinierung. Der Prozess wendet genügend thermische Energie an, um chemische Bindungen innerhalb einer Verbindung aufzubrechen und diese in einfachere Substanzen zu zersetzen.
Ein klassisches industrielles Beispiel ist die Herstellung von Kalk (Calciumoxid) aus Kalkstein (Calciumcarbonat). Beim Erhitzen zersetzt sich das Carbonat und setzt Kohlendioxidgas frei.
CaCO₃ (fest) + Wärme → CaO (fest) + CO₂ (Gas)
Das resultierende Calciumoxid ist ein grundlegender Bestandteil bei der Herstellung von Zement und Stahl.
Entfernung von flüchtigen Bestandteilen
Viele Rohminerale enthalten Wasser, entweder physikalisch absorbiert oder chemisch in ihrer Kristallstruktur gebunden (bekannt als Hydratwasser). Die Kalzinierung liefert die Energie, um dieses Wasser als Dampf auszutreiben.
Zum Beispiel beinhaltet die Umwandlung von Bauxit in Aluminiumoxid für die Aluminiumproduktion eine Kalzinierung, um das Hydratwasser zu entfernen. Ähnlich wird dieser Prozess verwendet, um flüchtige organische Stoffe aus verschiedenen Materialien zu entfernen.
Induzierung von Phasenübergängen
Manchmal besteht das Ziel nicht darin, die chemische Zusammensetzung zu ändern, sondern die physikalischen Eigenschaften des Materials zu verändern. Das Erhitzen eines Materials kann dazu führen, dass sich seine Atome zu einer anderen, oft stabileren oder funktionell nützlicheren Kristallstruktur neu anordnen.
Dies ist üblich bei der Herstellung von Katalysatoren und Keramikpigmenten, bei denen eine spezifische kristalline Phase die gewünschte katalytische Aktivität oder Farbe besitzt.
Schlüsselparameter, die den Prozess definieren
Die erfolgreiche Kalzinierung eines Materials erfordert eine präzise Kontrolle über mehrere Variablen. Diese Parameter bestimmen die Effizienz und das Ergebnis des gesamten Prozesses.
Die kritische Rolle der Temperatur
Die Kalzinierungstemperatur muss sorgfältig kontrolliert werden. Sie muss hoch genug sein, um die Aktivierungsenergie für die gewünschte Reaktion (z. B. Zersetzung) zu liefern, muss aber streng unterhalb des Schmelzpunktes des Materials bleiben.
Ist die Temperatur zu niedrig, ist die Reaktion unvollständig. Ist sie zu hoch, kann das Material schmelzen oder sintern (zusammenschmelzen), was typischerweise ein unerwünschtes Ergebnis ist.
Die kontrollierte Atmosphäre
Die Kalzinierung ist durch ihre sauerstoffarme oder sauerstofffreie Umgebung definiert. Dies ist entscheidend, um Oxidation zu verhindern, die eine völlig andere chemische Reaktion ist.
Prozesse, die Materialien in Gegenwart von reichlich Luft erhitzen, um bewusst Oxidation zu verursachen, werden als Rösten bezeichnet, nicht als Kalzinierung. Diese Unterscheidung ist grundlegend in der Metallurgie und Materialwissenschaft.
Verständnis der Kompromisse und Einschränkungen
Obwohl leistungsstark, ist die Kalzinierung nicht ohne Herausforderungen. Das Verständnis ihrer Einschränkungen ist der Schlüssel zu ihrer effektiven Anwendung.
Risiko des Sinterns
Schlechte Temperaturkontrolle ist das Hauptrisiko. Wenn die Temperatur zu nahe an den Schmelzpunkt des Materials kommt, können einzelne Partikel beginnen, miteinander zu verschmelzen. Dieser Sinterprozess reduziert die Oberfläche und kann die gewünschten Eigenschaften des Endprodukts ruinieren.
Energieintensität
Die Aufrechterhaltung der für die Kalzinierung erforderlichen hohen Temperaturen (oft 800-1000 °C oder höher) erfordert eine erhebliche Menge an Energie. Dies macht sie zu einem kostspieligen Prozess mit einem bemerkenswerten ökologischen Fußabdruck, insbesondere bei Reaktionen wie der Kalkproduktion, die große Mengen an CO₂ freisetzen.
Unvollständige Reaktionen
Eine 100%ige vollständige Reaktion kann schwierig zu erreichen sein. Wenn das Material nicht ausreichend lange erhitzt wird oder wenn der Wärmeübergang aufgrund großer Partikelgrößen schlecht ist, kann ein Teil des ursprünglichen, unzersetzten Materials zurückbleiben, was die Reinheit des Endprodukts beeinträchtigt.
Die richtige Wahl für Ihr Ziel treffen
Die spezifischen Parameter Ihres Kalzinierungsprozesses hängen vollständig von Ihrem gewünschten Endprodukt ab.
- Wenn Ihr Hauptaugenmerk auf der Herstellung eines Oxids aus einem Carbonat liegt: Sie müssen sicherstellen, dass die Temperatur hoch genug ist, um das gesamte CO₂ auszutreiben, aber niedrig genug, um ein Sintern des endgültigen Oxidprodukts zu verhindern.
- Wenn Ihr Hauptaugenmerk auf der Entfernung von Feuchtigkeit liegt: Ein niedrigeres Temperaturprofil kann ausreichen, wobei der Schwerpunkt auf dem Austreiben von Wasser ohne Auslösen unerwünschter chemischer Zersetzung liegt.
- Wenn Ihr Hauptaugenmerk auf dem Erreichen einer spezifischen Kristallphase liegt: Präzise Temperaturkontrolle und Haltezeit sind von größter Bedeutung, da Phasenübergänge innerhalb spezifischer Temperaturfenster stattfinden.
Letztendlich liegt die Beherrschung der Kalzinierung darin, sie als Werkzeug zu verstehen, um die endgültigen Eigenschaften eines Materials durch kontrollierte thermische Energie präzise zu gestalten.
Zusammenfassungstabelle:
| Ziel der Kalzinierung | Schlüsselmechanismus | Anwendungsbeispiel |
|---|---|---|
| Reinigung / Zersetzung | Thermische Zersetzung von Verbindungen (z. B. Carbonate). | Herstellung von Kalk (CaO) aus Kalkstein (CaCO₃). |
| Entfernung von flüchtigen Bestandteilen | Austreiben von Wasser (Hydratation) oder anderen flüchtigen Substanzen. | Umwandlung von Bauxit in Aluminiumoxid für die Aluminiumproduktion. |
| Phasenumwandlung | Neuanordnung der Kristallstruktur zur Veränderung der Materialeigenschaften. | Aktivierung von Katalysatoren oder Entwicklung von Keramikpigmenten. |
Bereit, Ihren Kalzinierungsprozess zu optimieren?
Präzise Temperaturkontrolle ist entscheidend für eine erfolgreiche Kalzinierung. KINTEK ist spezialisiert auf Hochleistungs-Laboröfen, die die Genauigkeit und Zuverlässigkeit liefern, die Ihr Labor für die Materialreinigung, Zersetzung und Phasenübergangsforschung benötigt.
Kontaktieren Sie KINTEK noch heute, um Ihre spezifische Anwendung zu besprechen. Unsere Experten helfen Ihnen bei der Auswahl der idealen Ausrüstung, um Ihre materialwissenschaftlichen Ziele zu erreichen.
Visuelle Anleitung
Ähnliche Produkte
- 1400℃ Muffelofen für Labor
- 1800℃ Muffelofen für Labor
- Labor-Muffelofen-Bodenhub-Muffelofen
- 1700℃ Muffelofen für Labor
- 1400℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
Andere fragen auch
- Wie stellt man die Muffelkammer ein? Eine Schritt-für-Schritt-Anleitung für einen sicheren und genauen Betrieb
- Was verursacht einen Anstieg des Aschegehalts? Entdecken Sie die versteckten Übeltäter, die Ihre Ausrüstung schädigen.
- Wie richtet man einen Muffelofen ein? Eine Schritt-für-Schritt-Anleitung für einen sicheren und präzisen Betrieb
- Welche Sicherheitsvorkehrungen sind für Muffelöfen zu treffen? Ein vollständiger Leitfaden für den sicheren Hochtemperaturbetrieb
- Was sind die Vorsichtsmaßnahmen für den Ofen? Wesentliche Sicherheitsschritte zum Schutz von Bedienern und Geräten



















