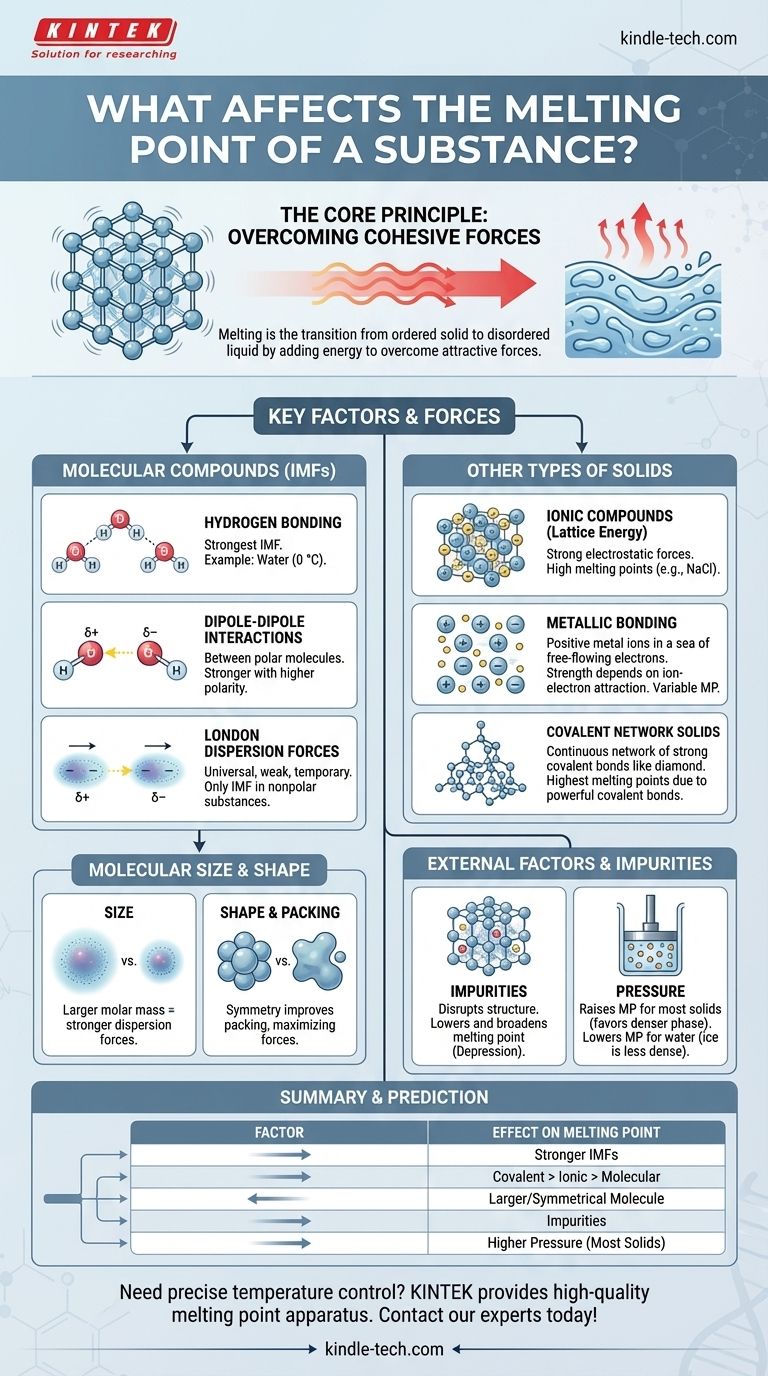
Im Kern wird der Schmelzpunkt einer Substanz durch die Energie bestimmt, die benötigt wird, um die anziehenden Kräfte zu überwinden, die ihre Partikel in einer festen, dreidimensionalen Struktur zusammenhalten. Die Hauptfaktoren sind die Stärke dieser Kräfte – ob chemische Bindungen oder schwächere intermolekulare Kräfte – und die Art und Weise, wie die Partikel zusammengepackt sind. Faktoren wie Molekülgröße, -form und das Vorhandensein von Verunreinigungen spielen ebenfalls eine entscheidende Rolle.
Das zentrale Prinzip ist einfach: Stärkere anziehende Kräfte zwischen Partikeln erfordern mehr thermische Energie, um sie zu brechen, was zu einem höheren Schmelzpunkt führt. Die gesamte Geschichte der Schmelzpunkte ist eine Erforschung dessen, was diese Kräfte erzeugt und modifiziert.

Das Kernprinzip: Überwindung von Kohäsionskräften
Schmelzen ist eine physikalische Umwandlung von einem geordneten festen Zustand in einen ungeordneten flüssigen Zustand. Das Verständnis dieses Übergangs ist der Schlüssel zum Verständnis der Faktoren, die ihn steuern.
Was ist Schmelzen?
In einem Feststoff sind Atome, Ionen oder Moleküle in einer festen Anordnung, einem Kristallgitter, eingeschlossen. Sie vibrieren an Ort und Stelle, bewegen sich aber nicht aneinander vorbei.
Schmelzen tritt bei der spezifischen Temperatur auf, bei der diese Partikel genügend kinetische Energie durch Wärme gewinnen, um sich aus ihren festen Positionen zu lösen und zu fließen zu beginnen.
Energie vs. Kohäsion
Die Wärme, die Sie einer Substanz zuführen, erhöht die kinetische Energie ihrer Partikel, wodurch diese intensiver vibrieren. Der Schmelzpunkt ist die Gleichgewichtstemperatur, bei der diese Vibrationsenergie stark genug wird, um die kohäsiven Kräfte zu überwinden, die das Gitter zusammenhalten.
Schlüsselfaktoren für molekulare Verbindungen
Bei Substanzen, die aus diskreten Molekülen bestehen (wie Wasser, Wachs oder Zucker), sind die Kräfte zwischen den Molekülen – nicht die Bindungen innerhalb dieser – das, was beim Schmelzen bricht. Diese werden als intermolekulare Kräfte (IMK) bezeichnet.
Wasserstoffbrückenbindungen: Die stärkste IMK
Eine Wasserstoffbrückenbindung ist eine starke Art der Dipol-Dipol-Wechselwirkung, die auftritt, wenn Wasserstoff an ein stark elektronegatives Atom wie Stickstoff (N), Sauerstoff (O) oder Fluor (F) gebunden ist.
Wasser (H₂O) ist ein klassisches Beispiel. Sein hoher Schmelzpunkt (0 °C) im Vergleich zu Molekülen ähnlicher Größe ist ausschließlich auf das starke Netzwerk von Wasserstoffbrückenbindungen zurückzuführen, die die Moleküle im Eis zusammenhalten.
Dipol-Dipol-Wechselwirkungen
Diese Kräfte existieren zwischen polaren Molekülen, die permanente partielle positive und partielle negative Enden haben. Das positive Ende eines Moleküls zieht das negative Ende seines Nachbarn an.
Je größer die Polarität des Moleküls, desto stärker die Dipol-Dipol-Anziehung und desto höher der Schmelzpunkt.
London-Dispersionskräfte: Die universelle Kraft
Diese temporären, schwachen Anziehungen existieren in allen Molekülen, sowohl polaren als auch unpolaren. Sie entstehen durch momentane Schwankungen in der Elektronenwolke um ein Molekül, die flüchtige Dipole erzeugen.
Bei unpolaren Substanzen wie Methan (CH₄) oder Oktan (C₈H₁₈) sind London-Dispersionskräfte die einzigen vorhandenen IMK.
Die Rolle von Molekülgröße und -form
Größe (Molmasse): Größere Moleküle haben größere Elektronenwolken, die leichter verzerrt werden können. Dies führt zu stärkeren London-Dispersionskräften und folglich zu höheren Schmelzpunkten. Aus diesem Grund sind große, wachsartige Kohlenwasserstoffe bei Raumtemperatur fest, während kleine wie Methan Gase sind.
Symmetrie und Packung: Moleküle, die symmetrisch und kompakt sind, können sich dichter und effizienter in ein Kristallgitter packen. Diese enge Packung maximiert die Wirksamkeit intermolekularer Kräfte, was zu einem höheren Schmelzpunkt führt als bei unregelmäßig geformten Isomeren gleicher Größe.
Jenseits von Molekülen: Andere Arten von Feststoffen
Nicht alle Feststoffe bestehen aus diskreten Molekülen. In vielen Materialien erfordert das Schmelzen das Brechen starker chemischer Bindungen, die sich durch die gesamte Struktur erstrecken.
Ionenverbindungen und Gitterenergie
In Ionenverbindungen wie Kochsalz (NaCl) werden positive und negative Ionen in einem starren Gitter durch starke elektrostatische Kräfte (Ionenbindungen) zusammengehalten. Das Schmelzen dieser Substanzen erfordert die Überwindung dieser immensen Anziehung, die durch die Gitterenergie gemessen wird.
Da Ionenbindungen weitaus stärker sind als intermolekulare Kräfte, haben Ionenverbindungen sehr hohe Schmelzpunkte.
Metalle und metallische Bindung
Metalle werden durch metallische Bindungen zusammengehalten, bei denen ein „Meer“ von delokalisierten Elektronen frei zwischen einem festen Gitter positiver Metallionen fließt.
Die Stärke der Anziehung zwischen den Ionen und diesem Elektronensee bestimmt den Schmelzpunkt. Metalle wie Wolfram und Titan bilden sehr starke metallische Bindungen und haben außergewöhnlich hohe Schmelzpunkte.
Kovalente Netzwerkfeststoffe
In diesen Materialien sind Atome durch ein kontinuierliches Netzwerk starker kovalenter Bindungen verbunden. Es gibt keine einzelnen Moleküle.
Um einen kovalenten Netzwerkfeststoff wie Diamant (Kohlenstoff) oder Quarz (Siliziumdioxid) zu schmelzen, müssen diese starken kovalenten Bindungen gebrochen werden. Dies erfordert eine enorme Energiemenge, was ihnen die höchsten Schmelzpunkte aller Substanzklassen verleiht.
Verständnis der Kompromisse und externen Faktoren
Die intrinsischen Eigenschaften einer Substanz sind nicht der einzige Einfluss. Externe Bedingungen und Zusammensetzung haben ebenfalls einen erheblichen Einfluss.
Die Wirkung von Verunreinigungen: Schmelzpunkterniedrigung
Das Vorhandensein einer Verunreinigung stört die gleichmäßige Struktur eines Kristallgitters. Dieses geschwächte, unorganisierte Gitter erfordert weniger Energie, um auseinanderzubrechen.
Dieses Phänomen ist als Schmelzpunkterniedrigung bekannt. Aus diesem Grund hat eine reine Substanz einen scharfen, ausgeprägten Schmelzpunkt, während eine unreine Substanz über einen breiten, niedrigeren Temperaturbereich schmilzt. Es ist auch das Prinzip hinter der Verwendung von Salz zum Schmelzen von Eis auf Winterstraßen.
Der Einfluss des Drucks
Bei den meisten Substanzen ist die feste Phase dichter als die flüssige Phase. Ein erhöhter Druck begünstigt den dichteren Zustand, drängt die Partikel näher zusammen und erschwert es ihnen, sich zu lösen. Daher erhöht ein höherer Druck bei den meisten Materialien den Schmelzpunkt.
Wasser ist eine berühmte Ausnahme. Da Eis weniger dicht ist als flüssiges Wasser, begünstigt ein erhöhter Druck den flüssigen Zustand, wodurch der Schmelzpunkt gesenkt wird.
So prognostizieren Sie relative Schmelzpunkte
Nutzen Sie diese Prinzipien, um verschiedene Substanzen zu vergleichen und ihr Verhalten vorherzusagen.
- Wenn Sie einen kovalenten Netzwerk-, Ionen- und Molekülverbindung vergleichen: Der kovalente Netzwerkfeststoff (z. B. Diamant) wird am höchsten sein, gefolgt von der Ionenverbindung (z. B. Salz), wobei die Molekülverbindung (z. B. Zucker) weitaus niedriger ist.
- Wenn Sie Molekülverbindungen vergleichen: Prüfen Sie zuerst auf Wasserstoffbrückenbindungen, die ein dominanter Faktor sind. Falls nicht vorhanden, vergleichen Sie die Polarität. Wenn alle unpolar sind oder eine ähnliche Polarität aufweisen, hat diejenige mit der größeren Molmasse im Allgemeinen den höheren Schmelzpunkt.
- Wenn Sie Ionenverbindungen vergleichen: Die Verbindung mit den höheren Ladungen auf ihren Ionen und/oder kleineren Ionenradien hat eine stärkere Gitterenergie und einen höheren Schmelzpunkt.
- Wenn Sie die Reinheit beurteilen müssen: Eine Substanz, die scharf bei ihrem bekannten Schmelzpunkt schmilzt, ist wahrscheinlich rein, während eine, die allmählich über einen Bereich unterhalb ihres erwarteten Punktes schmilzt, unrein ist.
Durch das Verständnis dieser grundlegenden Kräfte können Sie effektiv vorhersagen, wie die mikroskopische Struktur einer Substanz ihr Schmelzverhalten bestimmt.
Zusammenfassungstabelle:
| Faktor | Auswirkung auf den Schmelzpunkt | Schlüsselprinzip |
|---|---|---|
| Intermolekulare Kräfte (IMK) | Höher bei stärkeren IMK | Wasserstoffbrückenbindung > Dipol-Dipol > London-Dispersion |
| Art der chemischen Bindung | Kovalenter Netzwerkfeststoff > Ionisch > Metallisch > Molekular | Stärke der zu brechenden Bindungen |
| Molekülgröße/-form | Höher bei größerer Molmasse & symmetrischer Form | Erhöht die London-Kräfte und verbessert die Gitterpackung |
| Verunreinigungen | Senkt (Schmelzpunkterniedrigung) | Stört das Kristallgitter, erfordert weniger Energie zum Schmelzen |
| Druck | Erhöht (für die meisten Feststoffe); Senkt (für Eis/Wasser) | Begünstigt die dichtere Phase (fest für die meisten, flüssig für Wasser) |
Benötigen Sie präzise Temperaturkontrolle für Ihre Materialanalyse? Das Verständnis von Schmelzpunkten ist entscheidend für die Materialcharakterisierung, Reinheitsprüfung und Prozessentwicklung. KINTEK ist spezialisiert auf die Bereitstellung hochwertiger Laborgeräte, einschließlich Schmelzpunktapparaturen und Öfen, um Ihrem Labor zu helfen, genaue und zuverlässige Ergebnisse zu erzielen. Kontaktieren Sie unsere Experten noch heute, um die perfekte Lösung für Ihre spezifische Anwendung zu finden!
Visuelle Anleitung
Ähnliche Produkte
- Labor-Muffelofen-Bodenhub-Muffelofen
- 1800℃ Muffelofen für Labor
- 1400℃ Muffelofen für Labor
- 1700℃ Muffelofen für Labor
- 1400℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
Andere fragen auch
- Wie werden Kohlenstoffnanoröhren durch Laserverdampfung synthetisiert? Hochreine SWCNTs für fortschrittliche Technologien erschließen
- Was ist der Unterschied zwischen DC-Sputtern und DC-Magnetron-Sputtern? Erzielen Sie höhere Abscheidungsraten
- Warum wird Hochleistungsultraschall für MOFs in MMMs eingesetzt? Überlegene Gastrennung & gleichmäßige Dispersion freischalten
- Welche mechanischen Eigenschaften werden durch eine Wärmebehandlung beeinflusst? Härte, Festigkeit und Zähigkeit meistern
- Was ist die Funktion eines industriellen Mikrowellenofens bei der Mikrowellenaktivierung von Rotschlamm? Erhöhung der Porosität & Effizienz
- Was ist die Sputterrate? Meistern Sie den Schlüssel zur Kontrolle der Dünnschichtabscheidegeschwindigkeit
- Schaden Biokraftstoffe der Umwelt? Die Wahrheit über ihr CO2-neutrales Versprechen
- Was ist der Unterschied zwischen einem Aufstrom- und einem Horizontalofen? Finden Sie die perfekte Lösung für das Layout Ihres Hauses



















