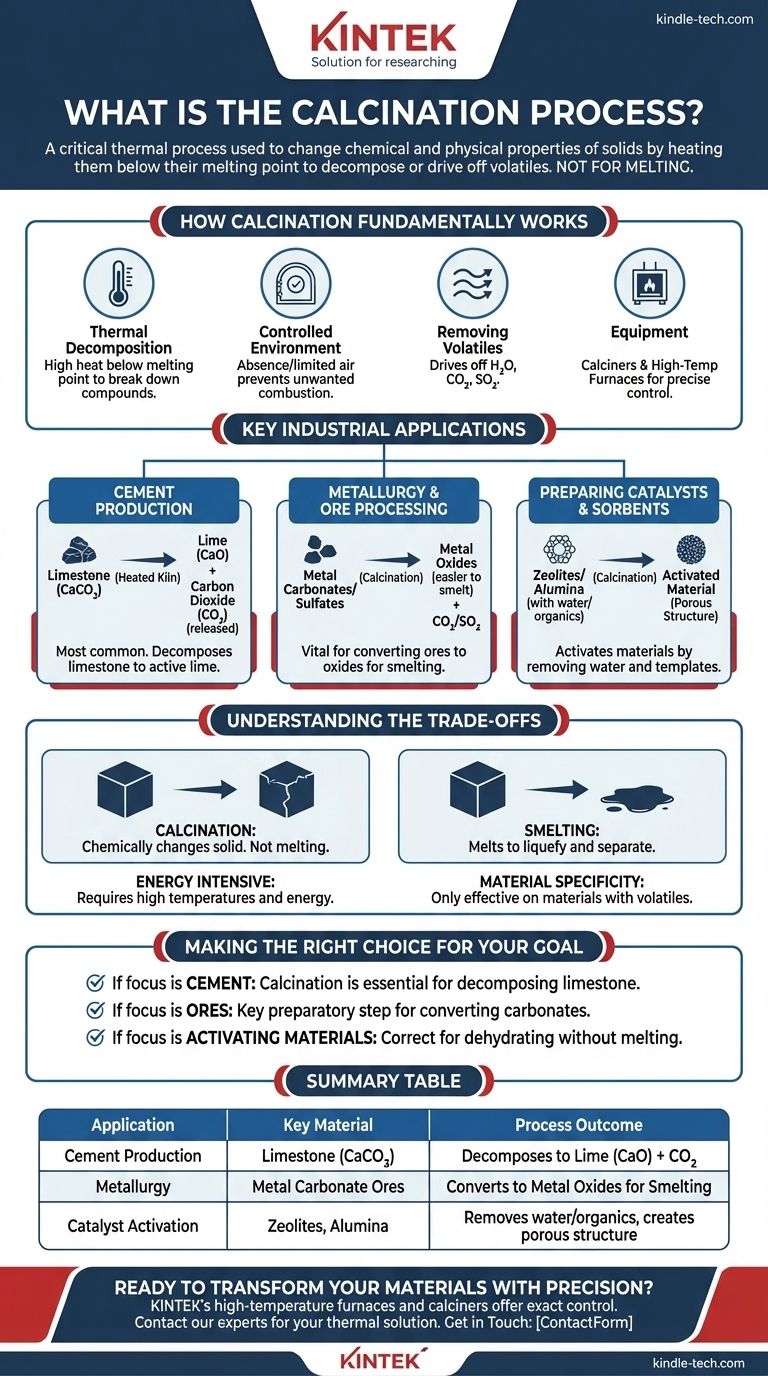
Im Wesentlichen ist die Kalzinierung ein kritischer thermischer Prozess, der zur Änderung der chemischen und physikalischen Eigenschaften fester Materialien verwendet wird. Zu den Haupteinsatzgebieten gehören die Zementherstellung, die Gewinnung von Metallen aus Erzen und die Entfernung flüchtiger Stoffe wie Wasser oder Kohlendioxid aus Feststoffen durch Erhitzen auf eine hohe Temperatur unterhalb ihres Schmelzpunktes.
Der Hauptzweck der Kalzinierung besteht nicht darin, ein Material zu schmelzen, sondern kontrollierte Hitze zur Zersetzung oder zum Austreiben einer flüchtigen Komponente zu nutzen. Dies verändert die Substanz grundlegend und bereitet sie für ihren nächsten industriellen Einsatz vor.

Wie die Kalzinierung grundlegend funktioniert
Die Kalzinierung ist eine präzise Wärmebehandlungstechnik. Das Verständnis ihrer Kernprinzipien ist der Schlüssel zur Wertschätzung ihrer breiten Anwendungspalette.
Das Kernprinzip: Thermische Zersetzung
Der Prozess beruht auf der thermischen Zersetzung, bei der hohe Hitze verwendet wird, um Verbindungen in einfachere Substanzen aufzuspalten. Entscheidend ist, dass die Temperatur knapp unterhalb des Schmelzpunktes des Materials gehalten wird, um sicherzustellen, dass die feste Struktur erhalten bleibt.
Die kontrollierte Umgebung
Die Kalzinierung wird in Abwesenheit oder bei begrenzter Zufuhr von Luft durchgeführt. Diese kontrollierte Atmosphäre verhindert eine unerwünschte Verbrennung und stellt sicher, dass die beabsichtigte chemische Zersetzung die primäre stattfindende Reaktion ist.
Das Hauptziel: Entfernung von flüchtigen Bestandteilen
Das Hauptziel ist die Entfernung eines flüchtigen Anteils aus dem Material. Dies beinhaltet oft das Austreiben von chemisch gebundenem Wasser (Dehydratisierung), Kohlendioxid aus Carbonaten oder Schwefeldioxid aus Sulfaten.
Die Ausrüstung: Kalzinieröfen und Industrieöfen
Dieser Prozess wird typischerweise in einem spezialisierten zylindrischen Reaktor, einem sogenannten Kalzinierofen, oder einem Hochtemperaturofen durchgeführt. Diese Geräte ermöglichen eine präzise Kontrolle über Temperatur und atmosphärische Bedingungen.
Wichtige industrielle Anwendungen
Die Prinzipien der Kalzinierung werden in mehreren wichtigen Industriezweigen angewendet, oft als grundlegender vorbereitender Schritt.
Zementherstellung
Dies ist die häufigste Anwendung der Kalzinierung. Kalkstein (Calciumcarbonat) wird in einem Ofen erhitzt, wodurch er sich in Kalk (Calciumoxid) und Kohlendioxid zersetzt. Der entstehende Kalk ist der primäre aktive Bestandteil in Zement.
Metallurgie und Erzverarbeitung
Die Kalzinierung ist ein wichtiger Schritt bei der Gewinnung von Metallen aus bestimmten Erzen. Sie wird verwendet, um Metallcarbonate oder sulfate in die entsprechenden Metalloxide umzuwandeln, die in nachfolgenden Schmelzprozessen leichter zu reinem Metall reduziert werden können.
Vorbereitung von Katalysatoren und Sorbentien
Materialien wie Zeolithe, Aluminiumoxid und Kieselgel werden oft kalziniert, um Wasser und organische Gerüstsubstanzen zu entfernen, die während ihrer Synthese verwendet wurden. Dieser Prozess aktiviert sie und erzeugt die poröse Struktur, die für ihre Funktion als Katalysatoren oder Sorbentien notwendig ist.
Verständnis der Kompromisse
Obwohl die Kalzinierung wirkungsvoll ist, handelt es sich um ein spezifisches Werkzeug mit inhärenten Einschränkungen, die seinen Einsatz bestimmen.
Kein Schmelzprozess
Es ist wichtig, die Kalzinierung vom Schmelzen zu unterscheiden. Die Kalzinierung zielt darauf ab, den Feststoff chemisch zu verändern, wohingegen beim Schmelzen ein Material weit über seinen Schmelzpunkt erhitzt wird, um es zu verflüssigen und abzutrennen.
Energieintensiv
Das Erreichen und Halten der für die thermische Zersetzung erforderlichen hohen Temperaturen erfordert eine erhebliche Menge an Energie. Dies macht die Kalzinierung zu einem potenziell kostspieligen und ressourcenintensiven Teil eines größeren industriellen Prozesses.
Materialspezifität
Der Prozess ist nur bei Materialien wirksam, die eine flüchtige Komponente enthalten, die durch Hitze ausgetrieben werden kann. Es ist keine universelle Methode zur Veränderung aller Feststoffe; ihr Nutzen hängt direkt von der chemischen Zusammensetzung des Ausgangsmaterials ab.
Die richtige Wahl für Ihr Ziel treffen
Die korrekte Anwendung der Kalzinierung hängt vollständig vom gewünschten Ergebnis für das Material ab.
- Wenn Ihr Hauptaugenmerk auf der Herstellung von Kalk für Zement liegt: Die Kalzinierung ist der wesentliche, unverzichtbare Prozess zur Zersetzung von Kalkstein in Calciumoxid.
- Wenn Ihr Hauptaugenmerk auf der Vorbereitung von Metallerzen für die Extraktion liegt: Die Kalzinierung ist der entscheidende vorbereitende Schritt zur Umwandlung von Carbonaterzen in Oxide vor dem Schmelzen.
- Wenn Ihr Hauptaugenmerk lediglich auf der Aktivierung eines Materials durch Wasserentzug liegt: Ein sorgfältig kontrollierter Kalzinierungsprozess ist der richtige Ansatz, um die Substanz zu dehydrieren, ohne ihre grundlegende Struktur zu verändern.
Letztendlich ermöglicht Ihnen das Verständnis der Kalzinierung, sie nicht nur als Erhitzen, sondern als präzises und transformatives Werkzeug für die Materialtechnik zu betrachten.
Zusammenfassungstabelle:
| Anwendung | Schlüsselmaterial | Prozessergebnis |
|---|---|---|
| Zementherstellung | Kalkstein (CaCO₃) | Zersetzt sich zu Kalk (CaO) + CO₂ |
| Metallurgie | Metallcarbonat-Erze | Umwandlung in Metalloxide zur Schmelze |
| Katalysatoraktivierung | Zeolithe, Aluminiumoxid | Entfernt Wasser/organische Stoffe, erzeugt poröse Struktur |
Bereit, Ihre Materialien mit Präzision zu transformieren?
Ob Sie neue Katalysatoren entwickeln, Erze verarbeiten oder an fortschrittlicher Keramik arbeiten – eine präzise Wärmebehandlung ist entscheidend. Die Hochtemperaturöfen und Kalzinieröfen von KINTEK sind für die genaue Kontrolle ausgelegt, die für erfolgreiche Kalzinierungsprozesse erforderlich ist.
Wir bieten robuste Laborgeräte, die auf Ihre Forschungs- und Produktionsziele zugeschnitten sind. Kontaktieren Sie noch heute unsere Experten, um die perfekte thermische Lösung für Ihre Anwendung zu finden.
Nehmen Sie Kontakt auf, um Ihre Kalzinierungsanforderungen zu besprechen
Visuelle Anleitung
Ähnliche Produkte
- Elektrische Drehrohrofen-Pyrolyseofenanlage Kalzinator Kleiner Drehrohrofen Rotierender Ofen
- Elektrischer Drehrohrofen Kontinuierlicher Betrieb Kleine Drehrohrofen Heizpyrolyseanlage
- Rotationsrohrofen mit geteilter Mehrfachheizzone
- Vakuumversiegelter kontinuierlich arbeitender Drehtiegelofen Rotierender Röhrenofen
- Elektrischer Drehrohrofen Kleiner Drehofen zur Regenerierung von Aktivkohle
Andere fragen auch
- Welche Zonen gibt es im Drehofen bei der Zementherstellung? Meistern Sie den Kernprozess für hochwertigen Klinker
- Was ist das Prinzip des Drehrohrofens? Beherrschen der kontinuierlichen thermischen Verarbeitung
- Was sind die verschiedenen Reaktortypen bei der Kunststoffpyrolyse? Wählen Sie das richtige System für Ihren Abfall
- Welche Biomasse wird bei der Pyrolyse verwendet? Auswahl des optimalen Rohstoffs für Ihre Ziele
- Was ist der Unterschied zwischen Kalzinieren und Rösten? Ein Leitfaden zur Hochtemperaturverarbeitung



















