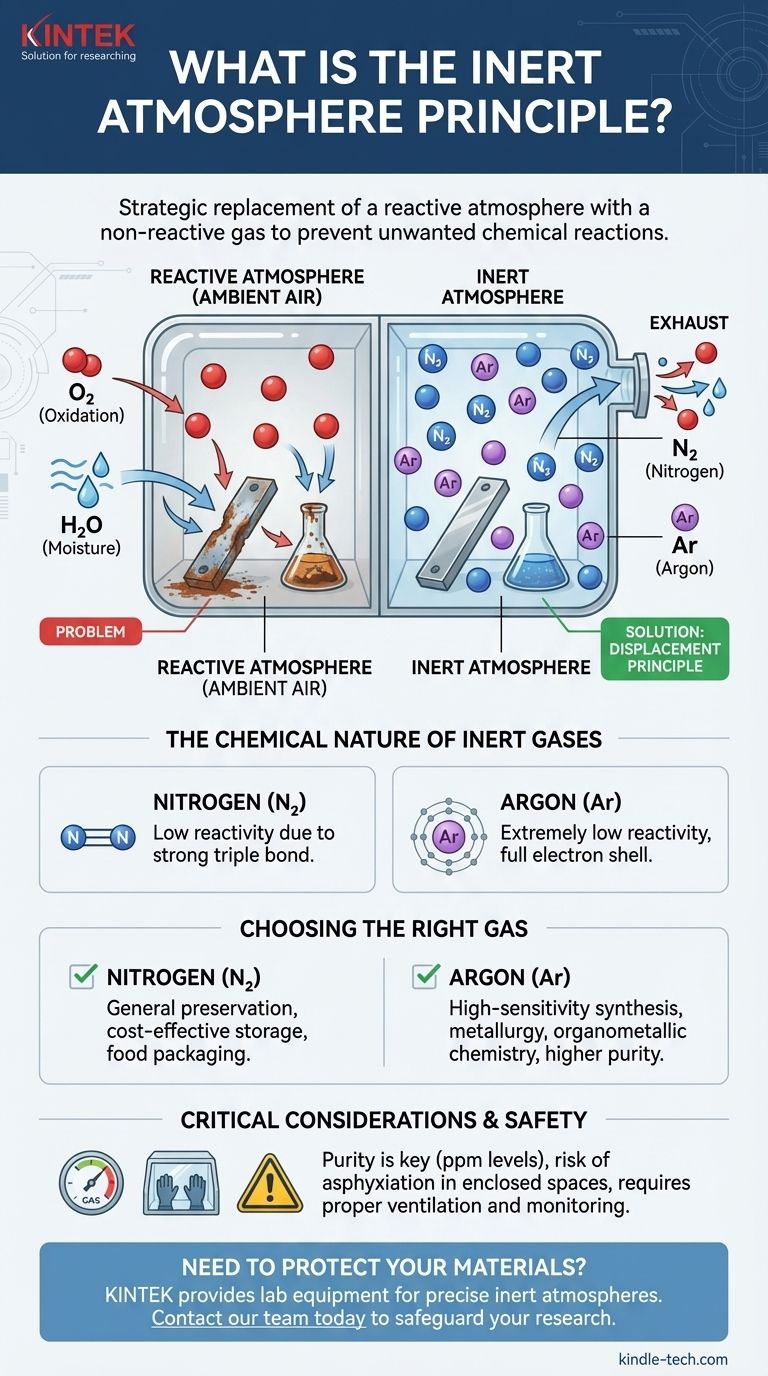
Das Prinzip der inerten Atmosphäre ist der strategische Ersatz einer reaktiven Atmosphäre, wie z.B. Umgebungsluft, durch ein nicht-reaktives (inertes) Gas. Dies geschieht, um eine kontrollierte Umgebung zu schaffen, die unerwünschte chemische Reaktionen wie Oxidation und feuchtigkeitsbedingten Abbau verhindert. Die am häufigsten verwendeten inerten Gase für diesen Zweck sind Stickstoff und Argon, die Sauerstoff und Wasserdampf aus einem System verdrängen.
Das Ziel einer inerten Atmosphäre ist nicht das Hinzufügen einer speziellen Zutat, sondern das Entfernen problematischer Bestandteile. Durch die systematische Verdrängung reaktiver Gase wie Sauerstoff und Wasser schaffen Sie eine stabile Umgebung, die empfindliche Materialien schützt und sicherstellt, dass chemische Prozesse ohne Störungen ablaufen.

Das Problem: Unkontrollierte atmosphärische Reaktivität
Normale Luft, die Umgebung, in der wir existieren, ist eine überraschend reaktive chemische Mischung. Für viele wissenschaftliche und industrielle Prozesse stellt diese Reaktivität ein erhebliches Problem dar.
Warum normale Luft eine Herausforderung ist
Unsere Atmosphäre besteht zu etwa 21 % aus Sauerstoff und variablen Mengen an Wasserdampf. Beide Komponenten sind hochreaktiv und bereit, an chemischen Reaktionen teilzunehmen.
Sauerstoff ist ein starkes Oxidationsmittel, was bedeutet, dass er leicht Elektronen von anderen Substanzen aufnimmt. Dies ist die Ursache für gängige Prozesse wie Rostbildung und Verbrennung.
Die Auswirkungen von Oxidation und Degradation
Wenn empfindliche Materialien der Luft ausgesetzt werden, können sie schnell degradieren. Zum Beispiel kann Sauerstoff ein empfindliches elektrochemisches Experiment ruinieren, indem er an der Elektrodenoberfläche reagiert und die Messergebnisse, die Sie zu erzielen versuchen, verdeckt.
Ähnlich zersetzen sich viele fortschrittliche Chemikalien, Pharmazeutika und Reagenzien oder verlieren ihre Wirksamkeit, wenn sie Sauerstoff oder Feuchtigkeit ausgesetzt werden. Dieses Prinzip ist auch der Grund, warum Lebensmittelhersteller Produkte wie Kartoffelchips in stickstoffgefüllten Beuteln verpacken, um zu verhindern, dass die Öle ranzig werden.
Wie eine inerte Atmosphäre das Problem löst
Eine inerte Atmosphäre wirkt der Bedrohung durch atmosphärische Reaktivität direkt entgegen, indem sie die Umgebung auf gasförmiger Ebene physikalisch verändert.
Das Verdrängungsprinzip
Die Kerntechnik besteht darin, einen Behälter, ein Reaktionsgefäß oder eine Kammer mit einem inerten Gas zu spülen. Wenn das inerte Gas einströmt, drängt es die Umgebungsluft, die Sauerstoff und Wasserdampf enthält, physikalisch heraus oder verdrängt sie.
Dies wird oft erreicht, indem das inerte Gas (wie Argon oder Stickstoff) durch eine flüssige Lösung geblasen oder ein geschlossener Behälter, wie z.B. eine Handschuhbox, kontinuierlich gespült wird.
Die chemische Natur inerter Gase
Gase wie Stickstoff (N₂) und Argon (Ar) werden gewählt, weil sie extrem nicht-reaktiv sind.
Argon ist ein Edelgas, was bedeutet, dass seine äußerste Elektronenschale voll ist. Es hat keinen chemischen Anreiz, mit anderen Elementen zu reagieren.
Stickstoffgas ist ein zweiatomiges Molekül (N₂), das durch eine außergewöhnlich starke Dreifachbindung zusammengehalten wird. Eine erhebliche Energiemenge ist erforderlich, um diese Bindung zu brechen, was Stickstoffgas sehr stabil und unter normalen Bedingungen unwahrscheinlich macht, an den meisten Reaktionen teilzunehmen.
Die Kompromisse verstehen
Während das Prinzip unkompliziert ist, beinhaltet seine praktische Anwendung wichtige Entscheidungen und potenzielle Herausforderungen.
Das richtige Gas wählen: Stickstoff vs. Argon
Stickstoff ist das Arbeitstier inerter Atmosphären. Er ist weitaus kostengünstiger als Argon und für die überwiegende Mehrheit der Anwendungen, von der Lebensmittelverpackung bis zur allgemeinen Chemikalienlagerung, ausreichend inert.
Argon wird für hochsensible Anwendungen eingesetzt, bei denen selbst die geringste Reaktivität nicht toleriert werden kann. Es ist chemisch inerter als Stickstoff und kann, da es dichter als Luft ist, eine stabilere Schutzschicht über einem Prozess bilden. Dies macht es ideal für die Hochtemperaturmetallurgie und die empfindliche organometallische Synthese.
Die Herausforderung der Reinheit
Ein einmaliges Spülen eines Systems reicht möglicherweise nicht aus. Selbst Spuren von Sauerstoff oder Wasserdampf (gemessen in Teilen pro Million) können ausreichen, um hochsensible Experimente zu stören oder ultrareine Materialien zu degradieren.
Das Erreichen und Aufrechterhalten eines hohen Reinheitsgrades erfordert oft kontinuierliches Spülen, sorgfältiges Abdichten des Systems und manchmal den Einsatz von Sauerstoff-Scrubbern, um die letzten Restspuren zu entfernen.
Kritische Sicherheitsaspekte
Inerte Gase sind einfache Erstickungsmittel. Sie sind nicht toxisch, aber sie verdrängen den zum Atmen notwendigen Sauerstoff. Das Arbeiten in einem geschlossenen Raum, in dem ein inertes Gas verwendet wird, kann extrem gefährlich sein und erfordert eine angemessene Belüftung und kontinuierliche Sauerstoffüberwachung, um Erstickung zu verhindern.
Die richtige Wahl für Ihr Ziel treffen
Die Wahl des richtigen Ansatzes hängt vollständig von Ihrem Ziel, Ihrem Budget und Ihren Empfindlichkeitsanforderungen ab.
- Wenn Ihr Hauptaugenmerk auf allgemeiner Konservierung oder Massenlagerung liegt: Stickstoff ist fast immer die kostengünstigste und praktischste Wahl zur Verhinderung von Oxidation.
- Wenn Ihr Hauptaugenmerk auf hochsensibler Synthese oder Elektrochemie liegt: Argon ist die überlegene Wahl aufgrund seiner nahezu vollständigen Reaktionslosigkeit, was seine höheren Kosten rechtfertigt.
- Wenn Ihr Hauptaugenmerk auf der Hochtemperatur-Metallverarbeitung liegt: Argon ist unerlässlich, da Stickstoff bei hohen Temperaturen mit einigen Metallen reagieren kann, um unerwünschte Nitride zu bilden.
Letztendlich geht es beim Beherrschen des Prinzips der inerten Atmosphäre darum, die chemische Umgebung zu kontrollieren, um vorhersehbare und zuverlässige Ergebnisse zu erzielen.
Übersichtstabelle:
| Aspekt | Stickstoff (N₂) | Argon (Ar) |
|---|---|---|
| Primäre Verwendung | Allgemeine Konservierung, kostengünstige Lagerung | Hochsensible Synthese, Hochtemperaturprozesse |
| Reaktivität | Gering (starke Dreifachbindung) | Extrem gering (Edelgas) |
| Kosten | Niedriger | Höher |
| Ideal für | Lebensmittelverpackung, Massenlagerung von Chemikalien | Metallurgie, Organometallchemie, empfindliche Elektrochemie |
Müssen Sie Ihre Materialien oder Prozesse vor Oxidation schützen?
Bei KINTEK sind wir darauf spezialisiert, die richtige Laborausrüstung und Verbrauchsmaterialien bereitzustellen, um präzise inerte Atmosphären für Ihre spezifische Anwendung zu schaffen und aufrechtzuerhalten. Ob Sie eine kostengünstige Stickstofflösung oder eine ultrareine Argonumgebung für empfindliche Arbeiten benötigen, unsere Experten können Ihnen bei der Auswahl des optimalen Systems helfen.
Kontaktieren Sie unser Team noch heute, um zu besprechen, wie wir Ihre Forschung und Produktion mit zuverlässigen Lösungen für inerte Atmosphären schützen können.
Visuelle Anleitung
Ähnliche Produkte
- 1200℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- 1400℃ Kammerofen mit kontrollierter Atmosphäre und Stickstoff- und Inertgasatmosphäre
- 1700℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- Kontrollierter Hochtemperatur-Wasserstoff-Ofen
- 1400℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
Andere fragen auch
- Wie simuliert ein Hochtemperatur-Atmosphäreofen die Einsatzumgebungen zur Bewertung der CMAS-Korrosionsbeständigkeit?
- Was ist der Unterschied zwischen oxidierenden und reduzierenden Atmosphären? Wichtige Erkenntnisse für Ihre Anwendungen
- Warum ist die Aufrechterhaltung einer inerten Stickstoffatmosphäre während der Pyrolyse notwendig? Schützen Sie Ihre Nanokompositsynthese
- Warum wird ein Hochtemperatur-Atmosphäresofen für 20Cr-25Ni-Nb-Edelstahl benötigt? Leitfaden zur Experten-Wärmebehandlung
- Was ist eine Inertgasatmosphäre und für welche Anwendungen wird sie eingesetzt? Wesentlicher Leitfaden für Wärmebehandlung & Laborsicherheit
- Was bedeutet das Inertisieren eines Raumes? Ein Leitfaden zur Beseitigung von Brand- und Explosionsgefahren
- Was ist dissoziiertes Ammoniak? Eine kostengünstige Wasserstoffquelle für die Wärmebehandlung
- Wie erzeugt man eine inerte Atmosphäre in einem Ofen? Beherrschen Sie die Vakuum-Spülmethode für oxidationsfreie Ergebnisse



















