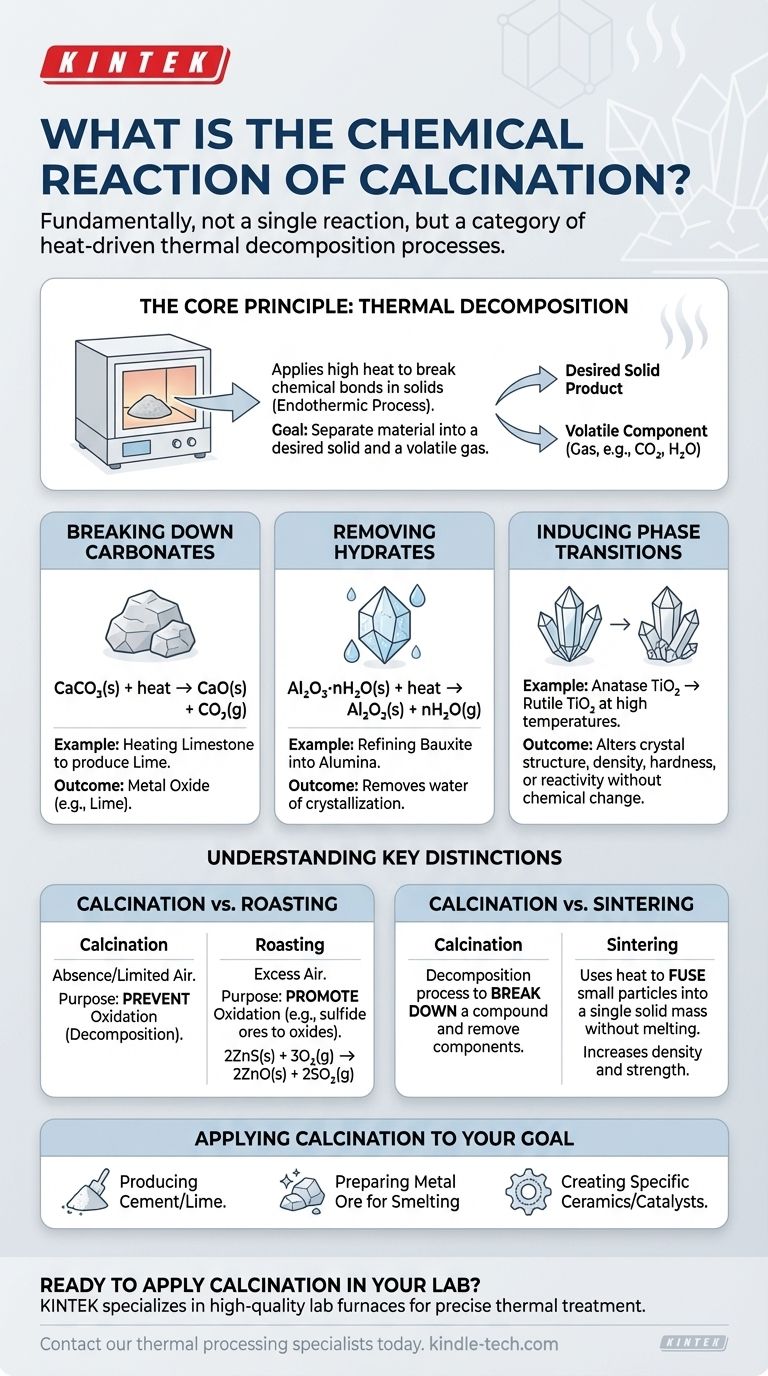
Grundsätzlich ist die Kalzinierung keine einzelne chemische Reaktion, sondern eine Kategorie von wärmegetriebenen Prozessen, die durch ein spezifisches Ergebnis definiert sind: die thermische Zersetzung. Obwohl viele Reaktionen unter diesen Oberbegriff fallen, ist das häufigste Beispiel die Zersetzung eines Carbonats, wie das Erhitzen von Kalkstein (Calciumcarbonat) zur Herstellung von Kalk (Calciumoxid) und Kohlendioxidgas.
Kalzinierung ist ein thermischer Behandlungsprozess, der hohe Hitze in einer kontrollierten Atmosphäre nutzt, um ein Material zu zersetzen. Ihr Hauptzweck ist es, eine flüchtige Komponente – wie Kohlendioxid oder Wasser – auszutreiben, um das verbleibende feste Material zu reinigen oder dessen chemische und physikalische Eigenschaften zu verändern.

Das Kernprinzip: Thermische Zersetzung
Die Kalzinierung funktioniert, indem einem Feststoff genügend thermische Energie zugeführt wird, um seine chemischen Bindungen zu brechen. Dieser Prozess ist immer endotherm, das heißt, er erfordert eine Energiezufuhr (Wärme), um abzulaufen. Ziel ist es, das Material in ein gewünschtes festes Produkt und eine flüchtige Komponente zu zerlegen, die als Gas ausgetrieben werden kann.
Zersetzung von Carbonaten
Dies ist die klassische und am weitesten verbreitete Anwendung der Kalzinierung, insbesondere bei der Zementherstellung. Wenn ein Metallcarbonat erhitzt wird, zersetzt es sich in ein Metalloxid und Kohlendioxidgas.
Für Kalkstein lautet die Reaktion:
CaCO₃(s) + Wärme → CaO(s) + CO₂(g)
Hier zerfällt festes Calciumcarbonat in festes Calciumoxid (Kalk) und gasförmiges Kohlendioxid.
Entfernung von Hydraten (Kristallwasser)
Viele Mineralien existieren als Hydrate, was bedeutet, dass Wassermoleküle in ihre Kristallstruktur eingebaut sind. Die Kalzinierung wird verwendet, um dieses Wasser auszutreiben, ein Prozess, der oft als "Trocknung" bezeichnet wird, obwohl es sich um eine chemische Zersetzung handelt.
Zum Beispiel beinhaltet die Raffination von Bauxiterz zu Aluminiumoxid die Kalzinierung von hydratisiertem Aluminiumoxid:
Al₂O₃·nH₂O(s) + Wärme → Al₂O₃(s) + nH₂O(g)
Dieser Schritt entfernt das Wasser und konzentriert das Aluminiumoxid, das eine notwendige Vorstufe für die Herstellung von Aluminiummetall ist.
Induzierung von Phasenübergängen
Seltener kann sich Kalzinierung auf einen Prozess beziehen, bei dem Wärme keine Zersetzung verursacht, sondern die Kristallstruktur (Phase) eines Materials verändert. Dies verändert seine physikalischen Eigenschaften, wie Dichte, Härte oder Reaktivität, ohne seine chemische Formel zu ändern.
Ein Beispiel ist die Umwandlung von Anatas, einer Form von Titandioxid (TiO₂), in seine stabilere Rutilphase bei hohen Temperaturen.
Die wichtigsten Unterscheidungen verstehen
Der Wert der Kalzinierung wird klarer, wenn man sie mit anderen gängigen thermischen Prozessen vergleicht. Die spezifischen Bedingungen – insbesondere die Atmosphäre – bestimmen das Ergebnis.
Kalzinierung vs. Rösten
Dies ist die wichtigste Unterscheidung. Die Kalzinierung erfolgt in Abwesenheit oder begrenzter Zufuhr von Luft, um die Oxidation bewusst zu verhindern.
Das Rösten hingegen erfolgt in einem Luftüberschuss, um die Oxidation gezielt zu fördern. Es wird typischerweise bei Sulfiderzen angewendet, um diese in Oxide umzuwandeln. Zum Beispiel das Rösten von Zinksulfid:
2ZnS(s) + 3O₂(g) → 2ZnO(s) + 2SO₂(g)
Kalzinierung vs. Sintern
Diese Prozesse haben gegensätzliche Ziele. Kalzinierung ist ein Zersetzungsprozess, der verwendet wird, um eine Verbindung zu zerlegen und eine Komponente zu entfernen.
Sintern hingegen nutzt Wärme (unterhalb des Schmelzpunktes), um kleine Partikel zu einer einzigen, festen Masse zu verschmelzen. Es erhöht Dichte und Festigkeit, indem es das Material im Wesentlichen "verschweißt", ohne es zu schmelzen.
Anwendung der Kalzinierung für Ihr Ziel
Die spezifische Kalzinierungsreaktion, die für Sie relevant ist, hängt vollständig von Ihrem Ausgangsmaterial und dem gewünschten Endprodukt ab.
- Wenn Ihr Hauptaugenmerk auf der Herstellung von Zement oder Kalk liegt: Sie verwenden Kalzinierung, um Calciumcarbonat in reaktives Calciumoxid zu zersetzen.
- Wenn Ihr Hauptaugenmerk auf der Vorbereitung eines Metallerzes zum Schmelzen liegt: Sie verwenden wahrscheinlich Kalzinierung, um Wasser (aus Hydraten) oder Kohlendioxid (aus Carbonaten) zu entfernen, um den Metallgehalt anzureichern.
- Wenn Ihr Hauptaugenmerk auf der Herstellung einer bestimmten Keramik oder eines Katalysators liegt: Sie verwenden möglicherweise Kalzinierung, um eine gewünschte Kristallphase und Oberfläche in einem Material wie Aluminiumoxid oder Titandioxid zu erreichen.
Letztendlich ist die Kalzinierung ein grundlegendes Werkzeug in der Materialwissenschaft, um rohe Feststoffe in nützlichere, konzentriertere oder reaktivere Formen umzuwandeln.
Zusammenfassungstabelle:
| Art der Kalzinierungsreaktion | Beispielreaktion | Wichtigstes Ergebnis |
|---|---|---|
| Carbonatzersetzung | CaCO₃(s) + Wärme → CaO(s) + CO₂(g) |
Erzeugt Metalloxid (z.B. Kalk) |
| Hydratzersetzung | Al₂O₃·nH₂O(s) + Wärme → Al₂O₃(s) + nH₂O(g) |
Entfernt Kristallwasser |
| Phasenübergang | Anatas TiO₂ → Rutil TiO₂ | Verändert Kristallstruktur & Eigenschaften |
Bereit, die Kalzinierung in Ihrem Labor anzuwenden?
Ob Sie neue Katalysatoren entwickeln, Erze verarbeiten oder fortschrittliche Keramiken synthetisieren, eine präzise thermische Behandlung ist entscheidend. KINTEK ist spezialisiert auf hochwertige Laboröfen und -geräte, die für zuverlässige Kalzinierungsprozesse entwickelt wurden.
Wir bieten Ihnen die Werkzeuge, die Sie für gleichmäßiges Erhitzen, präzise Temperaturregelung und konsistente Ergebnisse benötigen. Lassen Sie sich von unseren Experten beraten, um die richtige Ausrüstung für Ihr spezifisches Material und Ihre Anwendung auszuwählen.
Kontaktieren Sie noch heute unsere Spezialisten für thermische Prozesse, um Ihre Projektanforderungen zu besprechen und zu erfahren, wie KINTEK Ihre Forschung und Entwicklung verbessern kann.
Visuelle Anleitung
Ähnliche Produkte
- Elektrische Drehrohrofen-Pyrolyseofenanlage Kalzinator Kleiner Drehrohrofen Rotierender Ofen
- Elektrischer Drehrohrofen Kontinuierlicher Betrieb Kleine Drehrohrofen Heizpyrolyseanlage
- Elektrischer Drehrohrofen Kleiner Drehofen zur Regenerierung von Aktivkohle
- Vakuumversiegelter kontinuierlich arbeitender Drehtiegelofen Rotierender Röhrenofen
- Labor-Schnelltemperatur-Prozess (RTP) Quarzrohr-Ofen
Andere fragen auch
- Welche Arten von Pyrolyse-Reaktoren werden in der Industrie eingesetzt? Wählen Sie die richtige Technologie für Ihr Produkt
- Welche Biomasse wird bei der Pyrolyse verwendet? Auswahl des optimalen Rohstoffs für Ihre Ziele
- Welche Ausrüstung wird bei der Pyrolyse verwendet? Den richtigen Reaktor für Ihren Rohstoff und Ihre Produkte wählen
- Welche Zonen gibt es im Drehofen bei der Zementherstellung? Meistern Sie den Kernprozess für hochwertigen Klinker
- Was ist das Prinzip des Drehrohrofens? Beherrschen der kontinuierlichen thermischen Verarbeitung



















