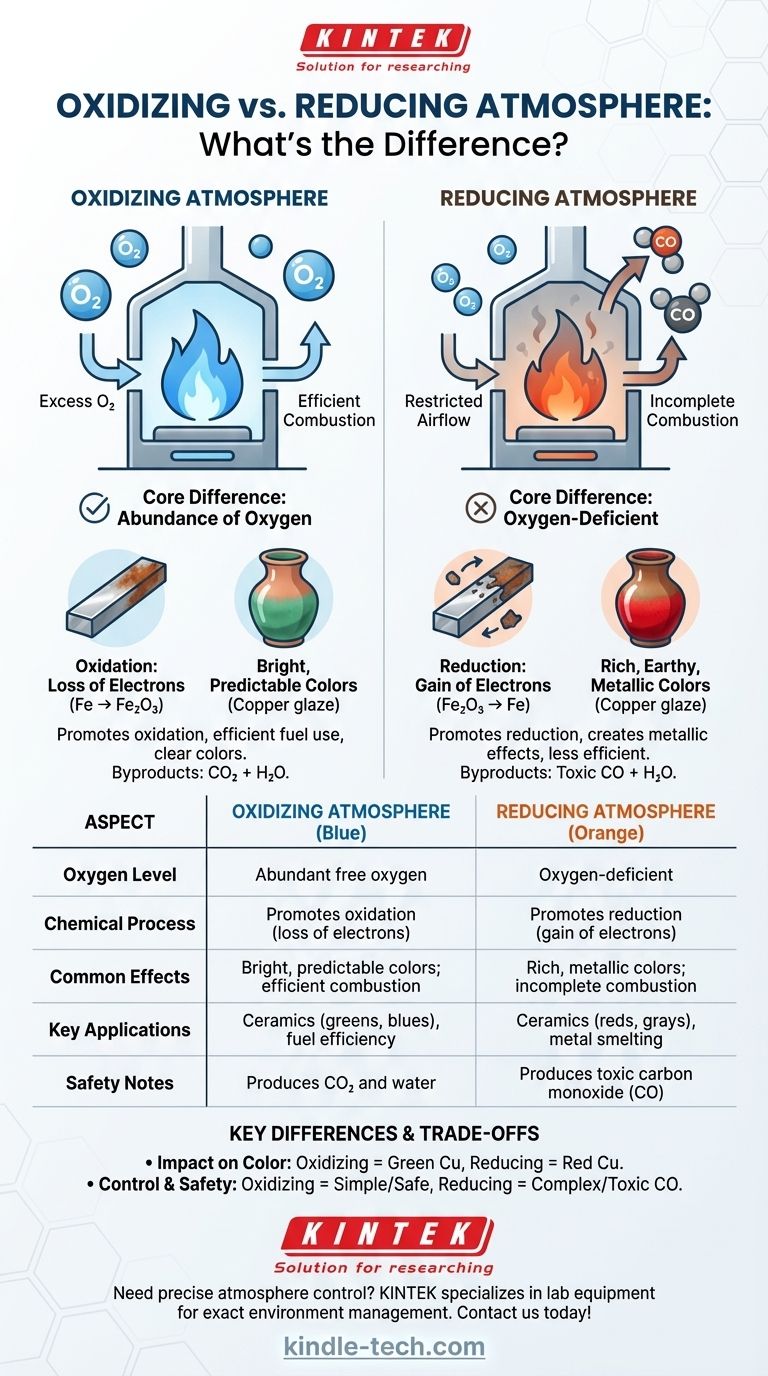
Im Kern liegt der Unterschied zwischen einer oxidierenden und einer reduzierenden Atmosphäre in der Verfügbarkeit von Sauerstoff. Eine oxidierende Atmosphäre hat einen Überschuss an freiem Sauerstoff, der chemische Reaktionen wie Verbrennung und Korrosion fördert. Eine reduzierende Atmosphäre ist sauerstoffarm und entzieht Materialien aktiv Sauerstoffatome, wodurch der Oxidationsprozess umgekehrt wird.
Die Wahl zwischen einer oxidierenden oder reduzierenden Atmosphäre ist ein grundlegender Kontrollmechanismus in der Materialwissenschaft und Chemie. Es geht nicht nur um die Umgebung; es ist ein Werkzeug, das verwendet wird, um den chemischen Zustand und die physikalischen Eigenschaften eines Materials gezielt zu verändern.
Was ist eine oxidierende Atmosphäre?
Eine oxidierende Atmosphäre ist der "Standardzustand", in dem wir leben, definiert durch das Vorhandensein von überschüssigem Sauerstoff. In Hochtemperaturanwendungen wie Brennöfen oder Schmelzöfen wird sie durch eine stetige und reichliche Zufuhr frischer Luft aufrechterhalten.
Die Rolle von überschüssigem Sauerstoff
Das Hauptmerkmal ist, dass mehr Sauerstoff verfügbar ist, als zur vollständigen Verbrennung jeglichen vorhandenen Brennstoffs erforderlich wäre. Dieser überschüssige Sauerstoff ist chemisch aktiv und bereit, mit anderen Materialien zu reagieren.
Der chemische Prozess: Oxidation
Oxidation ist eine chemische Reaktion, bei der eine Substanz Elektronen verliert. Obwohl auch andere Elemente dies verursachen können, beinhaltet es in diesem Zusammenhang fast immer die Bindung einer Substanz mit Sauerstoff. Dies ist derselbe grundlegende Prozess, der Eisen rosten lässt oder ein Feuer sauber brennen lässt.
Häufige Effekte und Anwendungen
Bei einem oxidierenden Brand verbrennt der Brennstoff effizient und vollständig, wodurch maximale Wärme mit wenig bis gar keinem Ruß erzeugt wird. In der Keramik führt dies zu klaren, hellen und oft vorhersehbaren Farben von Glasuren und Tonkörpern (z. B. Eisen erzeugt Beige- und Rottöne, Kupfer erzeugt Grün- und Blautöne).
Was ist eine reduzierende Atmosphäre?
Eine reduzierende Atmosphäre ist eine sauerstoffarme Umgebung. Sie wird in einem Brennofen oder Schmelzofen bewusst erzeugt, indem die Luftzufuhr eingeschränkt oder mehr Brennstoff zugeführt wird, als die verfügbare Luft verbrennen kann.
Die Rolle von unverbranntem Brennstoff
Bei unzureichendem Sauerstoff für eine vollständige Verbrennung setzt der unverbrannte Brennstoff Verbindungen wie Kohlenmonoxid (CO) und Wasserstoff frei. Diese Verbindungen sind chemisch instabil und suchen aggressiv nach Sauerstoffatomen, um sich mit ihnen zu verbinden.
Der chemische Prozess: Reduktion
Reduktion ist das Gegenteil von Oxidation; es ist eine chemische Reaktion, bei der eine Substanz Elektronen aufnimmt. In dieser Umgebung "stiehlt" das Kohlenmonoxid aktiv Sauerstoffatome von Metalloxiden im Ton oder in den Glasuren und reduziert sie zurück in einen metallischeren Zustand.
Häufige Effekte und Anwendungen
Ein reduzierender Brand ist oft kühler und rauchiger, ein Zeichen unvollständiger Verbrennung. Er ist unerlässlich für Prozesse wie das Schmelzen von Metall aus Erz. In der Keramik erzeugt er satte, komplexe und oft unvorhersehbare erdige und metallische Farben (z. B. Eisen erzeugt tiefe Blau- und Grautöne, Kupfer erzeugt leuchtende Rottöne).
Die wichtigsten Unterschiede und Kompromisse verstehen
Die Entscheidung, eine Atmosphäre gegenüber der anderen zu verwenden, hängt ausschließlich vom gewünschten Ergebnis ab, bringt aber erhebliche Kompromisse mit sich.
Auswirkungen auf Farbe und Materialeigenschaften
Dies ist der sichtbarste Unterschied. Eine kupferoxidhaltige Glasur wird grün in einer oxidierenden Atmosphäre. Dieselbe Glasur, wenn in einer reduzierenden Atmosphäre gebrannt, wird ihres Sauerstoffs beraubt, wodurch das Kupfer in seine metallische Form reduziert wird und ein brillantes Rot entsteht.
Kontrolle und Effizienz
Eine oxidierende Atmosphäre zu erreichen ist einfach: viel Luft zuführen. Eine reduzierende Atmosphäre zu erzeugen erfordert aktives Management, wie das Schließen einer Drosselklappe, um dem Feuer Sauerstoff zu entziehen. Dies macht den Prozess weniger kraftstoffeffizient, da Sie nicht die gesamte potenzielle Energie aus Ihrem Brennstoff gewinnen.
Sicherheit und Nebenprodukte
Oxidierende Brände erzeugen hauptsächlich Kohlendioxid (CO₂) und Wasser. Reduzierende Brände erzeugen aufgrund unvollständiger Verbrennung erhebliche Mengen an Kohlenmonoxid (CO), einem farb-, geruchlosen und hochgiftigen Gas. Eine ordnungsgemäße Belüftung ist absolut entscheidend, wenn eine reduzierende Atmosphäre erzeugt wird.
Wie man die richtige Atmosphäre wählt
Ihre Wahl hängt vollständig von Ihrem Material und Ihrem Ziel ab. Die Atmosphäre ist keine Hintergrundbedingung; sie ist ein aktiver Bestandteil des chemischen Prozesses.
- Wenn Ihr Hauptaugenmerk auf hellen, stabilen Farben und Kraftstoffeffizienz liegt: Verwenden Sie eine oxidierende Atmosphäre, indem Sie eine konstante, reichliche Luftzufuhr zu Ihrem Brennofen oder Schmelzofen gewährleisten.
- Wenn Ihr Hauptaugenmerk auf satten, erdigen oder metallischen Effekten in der Keramik liegt: Verwenden Sie eine reduzierende Atmosphäre, indem Sie die Luftzufuhr bei bestimmten Temperaturen sorgfältig einschränken, um die chemische Reduktion von Metalloxiden zu erzwingen.
- Wenn Ihr Hauptaugenmerk auf dem Schmelzen von Erz oder der Verhinderung von Oberflächenzunder auf Stahl liegt: Verwenden Sie eine stark reduzierende Atmosphäre, um dem Erz Sauerstoff zu entziehen oder dessen Bildung auf der Metalloberfläche zu verhindern.
Die Beherrschung des Zusammenspiels von Sauerstoff und Wärme ermöglicht Ihnen eine präzise Kontrolle über die endgültige Form und Funktion Ihres Materials.

Zusammenfassungstabelle:
| Aspekt | Oxidierende Atmosphäre | Reduzierende Atmosphäre |
|---|---|---|
| Sauerstoffgehalt | Reichlich freier Sauerstoff | Sauerstoffarm |
| Chemischer Prozess | Fördert Oxidation (Elektronenverlust) | Fördert Reduktion (Elektronengewinn) |
| Häufige Effekte | Helle, vorhersehbare Farben; effiziente Verbrennung | Satte, metallische Farben; unvollständige Verbrennung |
| Schlüsselanwendungen | Keramik (Grün, Blau), Kraftstoffeffizienz | Keramik (Rot, Grau), Metallschmelzen |
| Sicherheitshinweise | Produziert CO₂ und Wasser | Produziert giftiges Kohlenmonoxid (CO) |
Benötigen Sie eine präzise Atmosphärenkontrolle für Ihre Laborprozesse? KINTEK ist spezialisiert auf Laborgeräte und Verbrauchsmaterialien und bietet Öfen und Brennöfen, die eine exakte Kontrolle über oxidierende oder reduzierende Umgebungen ermöglichen. Egal, ob Sie neue Materialien entwickeln, Keramik testen oder Hochtemperaturexperimente durchführen, unsere Lösungen gewährleisten genaue, wiederholbare Ergebnisse. Kontaktieren Sie uns noch heute, um zu besprechen, wie wir die Fähigkeiten Ihres Labors verbessern können!
Visuelle Anleitung
Ähnliche Produkte
- 1200℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- Kontrollierter Hochtemperatur-Wasserstoff-Ofen
- 1400℃ Kammerofen mit kontrollierter Atmosphäre und Stickstoff- und Inertgasatmosphäre
- 1700℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- Rotationsrohrofen mit geteilter Mehrfachheizzone
Andere fragen auch
- Welche Rolle spielt ein Hochtemperatur-Atmosphäre-Ofen bei der Reinigung von geschmolzenen Chlorsalzen? Beherrschung der Dehydrierung.
- Welche Rolle spielen CO2 oder Dampf in einem industriellen Atmosphärenofen? Meisterung der physikalischen Aktivierung von Kohlenstoffmaterialien
- Wie behandelt ein Atmosphärenrohr-Ofen Na3SbS4-xSex-Elektrolyte? Erschließen Sie hohe Ionenleitfähigkeit
- Warum werden atmosphereskontrollierte Öfen für Verunreinigungen in Festkörperelektrolyten verwendet? Optimieren Sie jetzt Ihre Batterieforschung
- Wie beeinflusst die Temperaturregelpräzision eines Festkörperreaktionssinterofens lithiumreiche Materialien?
- Was ist die Schutzatmosphäre bei der Wärmebehandlung? Meistern Sie den Schlüssel zur Präzisionsmetallurgie
- Welche alternativen Atmosphären zu reinem Wasserstoff gibt es für Sinterprozesse in der Pulvermetallurgie? Top Sintering Solutions
- Warum sind Hochvakuum- oder atmosphärische Hochtemperaturöfen für Phosphatglasmatrizen erforderlich? Expertenratgeber



















